2006/437/ES2006/437/ES: Rozhodnutí Komise ze dne 4. srpna 2006 , kterým se schvaluje Diagnostická příručka pro influenzu ptáků podle směrnice Rady 2005/94/ES (oznámeno pod číslem K(2006) 3477) (Text s významem pro EHP)
| Publikováno: | Úř. věst. L 237, 8.5.2007, s. 1-27 | Druh předpisu: | Rozhodnutí |
| Přijato: | 4. srpna 2006 | Autor předpisu: | Evropská komise |
| Platnost od: | 1. července 2007 | Nabývá účinnosti: | 1. července 2007 |
| Platnost předpisu: | Zrušen předpisem (EU) 2020/689 | Pozbývá platnosti: | 21. dubna 2021 |
Text předpisu s celou hlavičkou je dostupný pouze pro registrované uživatele.
ROZHODNUTÍ KOMISE
ze dne 4. srpna 2006,
kterým se schvaluje Diagnostická příručka pro influenzu ptáků podle směrnice Rady 2005/94/ES
(oznámeno pod číslem K(2006) 3477)
(Text s významem pro EHP)
(2006/437/ES)
KOMISE EVROPSKÝCH SPOLEČENSTVÍ,
s ohledem na směrnici Rady 2005/94/ES ze dne 20. prosince 2005 o opatřeních Společenství pro tlumení influenzy ptáků a o zrušení směrnice 92/40/EHS (1), a zejména na čl. 50 odst. 1 druhý pododstavec uvedené směrnice,
vzhledem k těmto důvodům:
|
(1) |
Směrnice 2005/94/ES stanoví určitá preventivní opatření týkající se dozoru nad influenzou ptáků a její včasné detekce a rovněž minimálních opatření pro tlumení ohniska této nákazy u drůbeže a jiného ptactva chovaného v zajetí. |
|
(2) |
Na úrovni Společenství je nezbytné stanovit diagnostické postupy, metody odběru vzorků a kritéria hodnocení výsledků laboratorních testů k potvrzení ohniska influenzy ptáků. |
|
(3) |
V příloze VII směrnice 2005/94/ES jsou stanoveny funkce a úkoly referenční laboratoře Společenství pro influenzu ptáků, aby se po konzultaci s Komisí mohly metody používané v členských státech při stanovení diagnózy této nákazy koordinovat. Tyto funkce a úkoly zahrnují organizaci pravidelných srovnávacích testů a dodávání standardních činidel na úrovni Společenství. |
|
(4) |
V současné době byly vyvinuty laboratorní testy k zajištění rychlé diagnózy influenzy ptáků. |
|
(5) |
Zkušenosti získané v posledních letech s tlumením influenzy ptáků vedly k identifikaci nejvhodnějších postupů při odběru vzorků a kritérií pro hodnocení výsledků laboratorních testů ke správnému diagnostikování této nákazy v různých situacích. |
|
(6) |
Opatření stanovená tímto rozhodnutím jsou v souladu se stanoviskem Stálého výboru pro potravinový řetězec a zdraví zvířat, |
PŘIJALA TOTO ROZHODNUTÍ:
Článek 1
Schvaluje se diagnostická příručka podle směrnice 2005/94/ES, uvedená v příloze tohoto rozhodnutí.
Článek 2
Členské státy začnou diagnostickou příručku používat od data provedení směrnice 2005/94/ES anebo od 1. července 2007, přičemž rozhodující je dřívější datum.
Článek 3
Toto rozhodnutí je určeno členským státům.
V Bruselu dne 4. srpna 2006.
Za Komisi
Markos KYPRIANOU
člen Komise
(1) Úř. věst. L 10, 14.1.2006, s. 16.
PŘÍLOHA
DIAGNOSTICKÁ PŘÍRUČKA PRO INFLUENZU PTÁKŮ
KAPITOLA I
Úvod, cíle a definice
|
1. |
Za účelem zabezpečení jednotných postupů při zjišťování influenzy ptáků (AI) ve Společenství tato diagnostická příručka stanoví:
|
|
2. |
Tato diagnostická příručka je určena orgánům odpovědným za tlumení influenzy ptáků. Týká se proto zejména zásad a aplikací laboratorních testů a hodnocení jejich výsledků, a rovněž laboratorních technik. |
|
3. |
Pro účely této diagnostické příručky platí kromě definic uvedených v článku 2 směrnice 2005/94/ES i následující definice:
|
|
4. |
Potvrzení influenzy ptáků u drůbeže a jiného ptactva chovaného v zajetí musí být v souladu s postupy, metodami odběru vzorků a kritérii pro hodnocení výsledků laboratorních testů stanovenými v této diagnostické příručce, a musí se zakládat na jednom nebo více kritériích uvedených v písmenech a), b) a c):
|
|
5. |
Potvrzení nákazy savců virem influenzy typu A ptačího původu, který je vysoce patogenní, anebo, je-li nízkopatogenní, virem podtypů H5 nebo H7, musí splňovat jedno nebo více kritérií uvedených v písmenech a) nebo b):
|
|
6. |
Je nezbytné, aby dané postupy, metody odběru vzorků a kritéria hodnocení výsledků laboratorních testů byly:
|
KAPITOLA II
Popis influenzy ptáků s důrazem na diferenciální diagnózu
1. Etiologie a virulence
Influenza ptáků je vysoce nakažlivá virová infekce vyvolávaná viry z čeledi Orthomyxoviridae, rod influenzavirus A. Viry influenzy typu A jsou jedinými orthomyxoviry, o nichž je známo, že infikují ptáky. Prokázalo se, že řada ptačích druhů je vnímavá na nákazu viry influenzy typu A; vodní ptáci představují velký rezervoár takových virů, převážná většina izolátů je však u kuřat a krůt nízkopatogenní, přičemž se jedná o ptáky největšího hospodářského významu, jež nákaza postihuje.
Viry influenzy typu A obsahují antigenně příbuzné nukleoproteiny a antigenně příbuzné matrixové proteiny, na základě antigenní příbuznosti povrchových glykoproteinových antigenů hemaglutininu (HA) a neuraminidázy (NA) se však dělí na podtypy. V současnosti je známo 16 HA podtypů (H1–H16) a 9 NA podtypů (N1–N9). Každý virus influenzy typu A obsahuje jeden HA antigen a jeden NA antigen, zřejmě v jakékoliv kombinaci.
Viry influenzy typu A se na základě své schopnosti vyvolat onemocnění u vnímavé drůbeže dělí do dvou skupin:
|
a) |
viry vysoce patogenní influenzy ptáků (HPAI), které vyvolávají mimořádně závažné onemocnění charakterizované generalizovanou infekcí nakažené drůbeže, při níž může hrozit velmi vysoká úmrtnost hejna (až do sta procent), a |
|
b) |
viry nízkopatogenní influenzy ptáků (LPAI), které vyvolávají mírné, primárně respirační onemocnění drůbeže, pokud nedojde k exacerbaci v důsledku jiných souběžně probíhajících infekcí nebo faktorů. |
Jak se prokázalo izolací téměř všech možných kombinací HA a NA podtypů u volně žijících ptáků, tito ptáci a zejména stěhovavé vodní ptactvo sehrávají významnou roli jako rezervoár viru influenzy typu A. U volně žijících ptáků se zpravidla zjistily pouze LPAI viry, s výjimkou případů, kdy došlo k průniku HPAI virů od nakažené drůbeže.
Primární zavlečení virů influenzy ptáků na drůbežářská hospodářství s největší pravděpodobností souvisí s přímým nebo nepřímým kontaktem s volně žijícími ptáky.
U drůbeže chované v zajetí existuje možnost, že takové LPAI viry zavlečené z rezervoáru volně žijících ptáků mohou obíhat nepoznány, protože klinické příznaky jsou často mírné anebo zcela chybějí.
Jakmile se kmeny LPAI viru podtypů H5 a H7 zavlečou mezi drůbež, mohou zmutovat na HPAI kmeny. Zatím bylo prokázáno, že HPAI vyvolávají pouze viry podtypů H5 a H7.
I když v pozadí mutace LPAI viru na HPAI virus může být několik odpovědných mechanismů, faktory, které tuto mutaci vyvolávají, nejsou známy. V některých případech asi dochází k mutaci v primárním místě rychle po zavlečení viru volně žijícími ptáky, v jiných LPAI virus zase obíhá v drůbeži po celé měsíce, než zmutuje. Je tedy nemožné předvídat, zda a kdy taková mutace nastane. Lze však logicky předpokládat, že s rozšířenější cirkulací LPAI viru u drůbeže roste pravděpodobnost jeho zmutování na HPAI.
Odhadnout dobu inkubace je obtížné, pravděpodobně kolísá podle kmene viru a hostitele. Obvykle se uvádí v délce pěti až šesti dnů, v individuálních případech se však u ptáků může pohybovat v rozsahu od několika hodin až asi do sedmi dnů.
2. Klinické příznaky u ptáků infikovaných virem HPAI
Klinické příznaky jsou velmi variabilní, závislé na takových faktorech, jako je virulence viru vyvolávajícího nákazu, druh postižených ptáků, věk, pohlaví, současně probíhající onemocnění a životní prostředí.
K časným příznakům se řadí nechutenství, omezení příjmu vody a relativně nízká úmrtnost. Onemocnění však může v hejnu vzplanout i náhle, a řada ptáků pak může uhynout bez varovných známek anebo pouze s minimálními příznaky otupělosti, nechutenství, s načepýřeným peřím a horečkou. Zpravidla platí, že čím déle ptáci přežívají, tím výraznější jsou jejich klinické příznaky. Vývoj příznaků v čase závisí na viru, hostiteli a počáteční infikující dávce ve spojitosti s chovným systémem. Virus se šíří pomaleji u nosnic v klecích a ptáků ve výběhu než v zařízeních pro chov jatečních kuřat.
Slepice infikované virem HPAI mohou zpočátku snášet vejce s tenkou skořápkou, později se snáška může zcela zastavit. Nemocní ptáci často sedí nebo stojí v polokomatózním stavu s hlavou dotýkající se země. Hřebínky a lalůčky jsou cyanotické a edematózní, kolem jejich cípů se mohou objevit petechiální nebo tečkovité krváceniny. Častý je profúzní vodnatý průjem a nadměrná žíznivost. Dýchání může být ztížené a lze pozorovat nadměrné slzení. Na neopeřených oblastech kůže lze pozorovat krváceniny. Úmrtnost hejna dosahuje 50 až 100 %.
U jatečních kuřat jsou příznaky HPAI často méně zjevné než u ostatní drůbeže a obvykle zahrnují otupělost, nechutenství a výrazný nárůst úmrtnosti jako první pozorovanou abnormalitu. Možný je i edém obličejových partií a krku a lze zaznamenat i nervové příznaky, jako je tortikolis a ataxie.
HPAI u krůt připomíná průběhem nákazu u drůbeže chované v zajetí, některé viry HPAI se však u krůt mohou jevit jako virulentnější, zatímco jiné vykazují virulenci nižší.
U hus nakažených virem HPAI se příznaky otupělosti, nechutenství a průjem podobají příznakům u nosnic, i když se u nich často pozoruje edém dutin. U mladších ptáků se mohou dostavit nervové příznaky.
U kachen se při nákaze viry HPAI nemusí projevit žádné klinické příznaky, některé kmeny viru však mohou navodit příznaky podobající se průběhu u hus, provázené určitou úmrtností.
Klinické příznaky mohou u pštrosů nakažených HPAI a LPAI zcela chybět. V případě vzplanutí HPAI, například v Itálii v letech 1999 a 2000, se zjistilo, že perličky a japonské křepelky jsou vnímavé na nákazu, s příznaky a úmrtností podobnými nákaze u kuřat a krůt. Podle výsledků některých experimentálních studií jsou však křepelky vůči některým kmenům HPAI odolné. Přítomnost protilátek proti témuž podtypu H, bez ohledu na to, zda se vytvořily v důsledku očkování anebo přirozené nákazy, může znamenat, že nákaza virem HPAI nevede k manifestním klinickým příznakům.
3. Postmortální léze u ptáků nakažených virem HPAI
Perakutně uhynulí ptáci mohou vykazovat minimální makroskopické léze v souvislosti s dehydratací a kongescí vnitřních orgánů a svalů.
U ptáků uhynulých až po delším klinickém průběhu nákazy se vyskytují petechiální a tečkovité krváceniny po celém těle, zejména v hrtanu, průdušnici, proventrikulu – žláznatém žaludku a epikardiálním tuku a na serózních površích přiléhajících ke sternu. Pozoruje se rozsáhlý podkožní edém, zejména v okolí hlavy a hlezenních kloubů. Kadáver může být dehydrovaný. Ve slezině, játrech, ledvinách a plicích mohou být přítomna nekrotická ložiska žlutého nebo šedého zbarvení. Vzdušný vak může obsahovat výpotek. Slezina může být zvětšena, s přítomností krvácenin.
Histologicky je influenza ptáků charakterizována cévními poruchami, jež vedou k edému, krváceninám a k hromadění zánětlivých buněk kolem malých cév, zejména v srdečním svalu, slezině, plicích, mozku, slinivce břišní a lalůčcích. Nekrotická ložiska jsou přítomna v plicích, játrech a ledvinách. V mozku lze pozorovat gliózu, proliferaci cév a degeneraci neuronů.
4. Diferenciální diagnóza
V diferenciální diagnóze HPAI je třeba zvážit tato onemocnění:
|
a) |
ostatní onemocnění způsobující náhlou vysokou úmrtnost, například:
|
|
b) |
ostatní onemocnění vyvolávající otok hřebínků a lalůčků, například:
|
5. Klinické příznaky u ptáků nakažených viry LPAI
Stupeň závažnosti onemocnění vyvolaného viry LPAI je do značné míry ovlivněn:
|
a) |
kmenem viru; |
|
b) |
druhem a věkem hostitele; |
|
c) |
imunitním stavem hostitele ve vztahu k viru a zejména přítomností ostatních původců infekce, jako jsou:
|
|
d) |
onemocnění podmíněná imunodeficitem; |
|
e) |
faktory životního prostředí (například nadměrné hladiny čpavku, prašnost, vysoké nebo nízké teploty). |
Jedním extrémem jsou nejasné nebo lehké klinické příznaky onemocnění, pouze s mírnými respiračními potížemi nebo provázené problémy se snáškou u nosnic, druhým extrémem jsou naopak infekce viry LPAI, provázené vážnými klinickými příznaky onemocnění zejména u krůt, obvykle s plicními šelesty, kašlem, edémem podočnicových dutin a horečnatými stavy spojenými s nechutenstvím a vysokou úmrtností.
LPAI se může zaměnit nebo komplikovat s celou řadou onemocnění, provázených respiračními nebo střevními příznaky. V případě jakéhokoli vzplanutí nemoci u drůbeže, jež přetrvává přes zavedení preventivních a léčebných opatření pro jiná onemocnění, je třeba mít podezření na influenzu ptáků.
6. Klinické příznaky u ptáků chovaných v zajetí
Spektrum klinických příznaků může být velmi široké, a obdobně jako u drůbeže může zahrnovat nejasné až závažné příznaky onemocnění s následnou vysokou úmrtností.
Infekce se ve skupině ptáků chovaných v zajetí šíří zpravidla pomaleji proto, že se vedle sebe chovají nejrůznější druhy s různou vnímavostí a odlišnou hladinou vylučování viru, a relativně pomalý přenos zase souvisí s nízkou mírou kontaktu a relativně malou hustotou ptáků v dané skupině.
KAPITOLA III
Směrnice zvažované pro případ podezření na výskyt influenzy ptáků v hospodářství
Pestrost klinických příznaků jak u HPAI, tak u LPAI znemožňuje vypracování přesných směrnic pro případ podezření na vznik ohniska nemoci. Náhlou vysokou úmrtnost drůbeže s jakýmikoli průvodními klinickými příznaky popsanými v kapitole II anebo bez nich je třeba řešit předložením vzorků k laboratornímu vyšetření; jestliže však k vysoké úmrtnosti nedochází, je podezření na přítomnost influenzy ptáků nebo její vyloučení mnohem obtížnější.
Vzhledem k tomu, že diagnóza HPAI nebo LPAI vyvolaných podtypy H5 a H7 má prvořadý význam pro jejich včasné tlumení a vymýcení, je třeba s influenzou ptáků počítat v diferenciální diagnóze respiračních poruch, v případě problémů se snáškou a při zvýšené úmrtnosti u drůbeže, a odpovídající vzorky poslat k laboratornímu vyšetření.
Obrázek
Schematický přehled diagnostických kroků k potvrzení influenzy ptáků
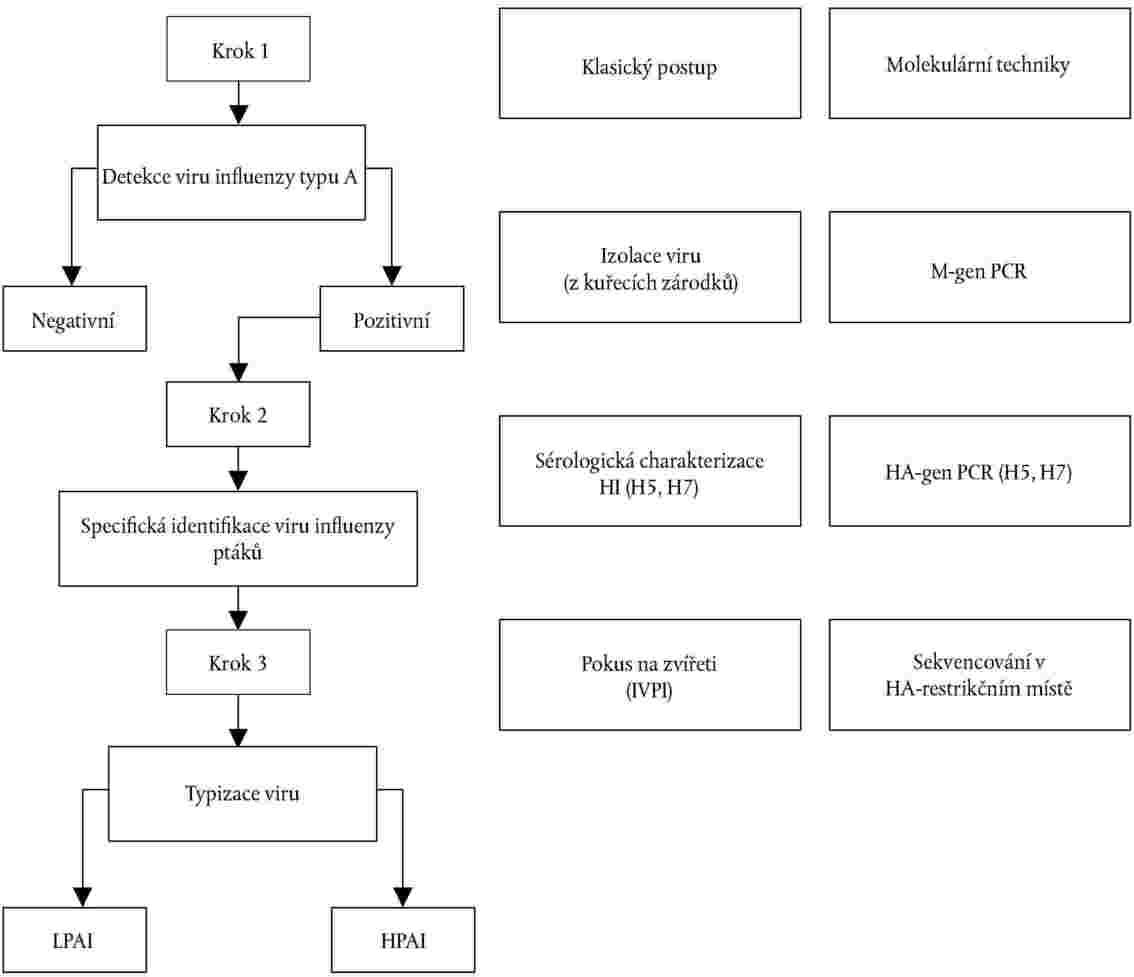
KAPITOLA IV
Všeobecné postupy při odběru a přepravě vzorků
1. Směrnice 2005/94/ES a diagnostická příručka
V případech, kde se ve směrnici 2005/94/ES odkazuje na diagnostickou příručku, musí se provést postupy, pokud jde o vyšetření, odběr vzorků a dozor, stanovené v této kapitole diagnostické příručky.
2. Postupy, jež je třeba dodržet v případě podezření na vzplanutí influenzy ptáků
V případě, že úřední veterinární lékař má klinické podezření na vzplanutí influenzy ptáků, anebo v případě, že výsledky kteréhokoli laboratorního testu na toto onemocnění nejsou negativní, musí příslušný orgán zajistit, aby se v souladu s článkem 7 směrnice 2005/94/ES provedlo vyšetření stanovené v této kapitole diagnostické příručky a uspokojivě se dokončilo ještě předtím, než se vyloučí přítomnost onemocnění.
3. Interpretace virologického vyšetření
Příslušný orgán může přítomnost viru influenzy ptáků vyloučit za předpokladu, že za účelem zjištění viru nebo jeho genomu byl zaslán odpovídající počet nemocných nebo uhynulých ptáků a tracheálních/orofaryngeálních nebo kloakálních výtěrů a byla použita alespoň jedna ze specifikovaných metod uvedených v kapitole V nebo VI anebo byly použity metody schválené příslušným orgánem v souladu s bodem 6 písm. b) kapitoly I a výsledky vyšetření provedené příslušnými testy byly negativní.
4. Standardní sada vzorků pro účely virologického nebo sérologického laboratorního vyšetření
Za účelem vyšetření hospodářství podezřelého z nákazy virem influenzy ptáků je třeba v souladu s písmeny a) a b) („standardní vzorky“) odebrat a přímo pro účely virologického a sérologického laboratorního vyšetření zaslat sadu vzorků pro virologické nebo sérologické vyšetření.
|
a) |
Standardní sadu vzorků pro účely virologického vyšetření tvoří:
Musí se odebrat mrtvá těla ptáků, kteří nedávno uhynuli, nebo ptáci, kteří jsou vážně nemocní anebo umírají a byli humánně utraceni. Výtěry je třeba odebrat tolika ptákům, kolik jich je uvedeno v písmenu a), anebo u všech ptáků hospodářství s podezřením na nákazu, kde jsou ptáci přítomni v menším počtu. Odběr se musí zaměřit na ptáky vykazující klinické příznaky onemocnění. Kloakální výtěry musí být obaleny trusem (optimálně v 1 g fekálního materiálu). Jestliže z jakéhokoli důvodu nelze kloakální výtěry živým ptákům odebrat, může se jako alternativy použít pečlivě odebraných vzorků čerstvého trusu. Často je praktičtější odebrat tracheální/orofaryngeální výtěry z ústní dutiny. Jakmile jsou růstové charakteristiky viru známy, příslušný orgán může v závislosti na tom, zda se virus množí lépe v dýchacím nebo trávicím traktu a rovněž s přihlédnutím k příslušnému druhu rozhodnout, že se spíše zvolí buď tracheální/orofaryngeální výtěry, nebo výtěry kloakální, než aby se odebraly oba tyto výtěry. |
|
b) |
Standardní sadu vzorků pro účely sérologického vyšetření představuje minimálně 20 krevních vzorků. Vzorky se musí odebrat tolika ptákům, kolik jich je uvedeno v písmenu b), nebo všem ptákům v hospodářství, kde je jich menší počet. Při odběru je třeba zaměřit se na zjevně nemocné ptáky anebo na ptáky, kteří se podle všeho uzdravili. Příslušný orgán může rozhodnout, že není třeba odebrat standardní vzorky v plném rozsahu, ale že lze místo toho odebrat jenom podskupinu vzorků. |
5. Přeprava vzorků
Zvláštní péči je třeba věnovat skladování a přepravě vzorků do laboratoře pro účely vyšetření.
Výtěry musí být okamžitě chlazeny pomocí ledu nebo sáčků se zmrazeným gelem a co možná nejrychleji odevzdány do laboratoře. Pokud to není absolutně nezbytné, vzorky se nezmrazují. Jestliže není zaručena rychlá přeprava do laboratoře do 24 hodin, vzorky se musejí ihned zmrazit, uskladnit a poté přepravit na suchém ledu.
Kromě toho a nikoli jako alternativa chlazení se výtěry musí vložit do antibiotického nebo specifického transportního virového média o teplotě 4 °C tak, aby byly zcela ponořeny. Není-li takové médium k dispozici, je třeba výtěry vrátit do jejich obalu a dodat do laboratoře k vyšetření suché.
Uskladnění a přepravu vzorků může ovlivnit řada faktorů, a proto musí být zvolená metoda přepravy pro tento účel vhodná.
6. Antibiotické médium
Antibiotické médium uvedené v bodě 5 musí být založeno na fosfátem pufrovaném fyziologickém roztoku (PBS) o pH 7,0–7,4 (měřeno po přidání antibiotik).
Média na bázi bílkovin, jako je brain-heart-infusion nebo třípufrovaný tryptózový bujón, mohou dodat viru na stabilitě, zejména během přepravy. Použitá antibiotika a jejich koncentrace se mohou lišit, aby se vyhovělo místním podmínkám i dostupnosti antibiotik.
U vzorků výkalů mohou být nezbytné velmi vysoké hladiny antibiotik. Jejich odpovídající výše je tato: 10 000 IU penicilinu/ml, 10 mg streptomycinu/ml, 0,25 mg gentamycinu/ml a 5 000 IU nystatinu/ml. Tyto hladiny se u tkání a tracheálních výtěrů mohou snížit až o pětinásobek.
Předpokládá-li se, že ve vzorku může být Chlamydophila, musí se doplnit 0,05–0,1 mg oxytetracyklinu/ml.
7. Živné médium brain-heart-infusion
Roztok je třeba připravit ve vodě a má před sterilizací (autoklávováním při teplotě 121 °C po dobu 15 minut) obsahovat 15 % hmotnosti/objemu práškového živného média brain-heart-infusion.
Po sterilizaci je třeba přidat antibiotika, a to 10 000 IU penicilinu G/ml, 20 μg amfotericinu B a 1 000 μg gentamycinu/ml. Média je třeba skladovat při teplotě 4 °C maximálně po dobu 2 měsíců.
8. Postupy, které je třeba provést s ohledem na příslušná ustanovení směrnice 2005/94/ES
8.A Podezření na vzplanutí nákazy
8.1 Čl. 7 odst. 1 – Opatření, která se mají použít v hospodářstvích při podezření na vzplanutí nákazy
V případě, že úřední veterinární lékař provádí v hospodářství podezřelém ze vzplanutí nákazy šetření, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství, pokud takové záznamy existují. Každodenní údaje o úmrtnosti a produkci vajec, příjmu krmiva a/nebo vody za období začínající jeden týden před datem vzniku klinických příznaků influenzy ptáků a končící datem inspekce hospodářství provedené úředním veterinárním lékařem je třeba doložit ve zprávě o inspekci, kterou vypracuje úřední veterinární lékař. |
|
b) |
Klinické šetření každé produkční jednotky, včetně vyhodnocení její klinické anamnézy a klinických vyšetření drůbeže a ostatních ptáků chovaných v zajetí, zejména ptáků jevících známky nemoci. |
|
c) |
Pokud příslušný orgán není přesvědčen, že podezření na vzplanutí nákazy je možno na základě klinického šetření v souladu s písmeny a) a b) vyloučit, musejí se odebrat standardní vzorky z každé produkční jednotky. |
|
d) |
Ještě předtím, než se bude moci zrušit úřední dozor, musí se nezávisle na negativních výsledcích vyšetření standardních vzorků a v závislosti na místních faktorech provést v každé produkční jednotce klinická šetření drůbeže. |
8.2 Čl. 10 odst. 3 – Další opatření na základě epidemiologického šetření
Z drůbeže nebo jiného ptactva chovaného v zajetí se po usmrcení musí v každé produkční jednotce odebrat standardní vzorky.
8.B Vysoce patogenní influenza ptáků (HPAI)
8.3 Čl. 11 odst. 4 – Opatření, která se mají použít v případech, kdy se drůbež vylíhne z vajec sebraných z hospodářství, kde nákaza již byla potvrzena
V případě, že úřední veterinární lékař provádí šetření v hospodářství, kde se nachází drůbež již vylíhnutá z vajec sebraných během doby inkubace v hospodářství, kde již byla HPAI potvrzena, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství. Každodenní údaje o úmrtnosti a produkci vajec, příjmu krmiva a/nebo vody, jsou-li takové údaje k dispozici, za období začínající jeden týden před datem vzniku klinických příznaků HPAI a končící datem inspekce hospodářství provedené úředním veterinárním lékařem je třeba doložit ve zprávě o inspekci hospodářství, kterou vypracuje úřední veterinární lékař. |
|
b) |
Klinické šetření v každé produkční jednotce a klinické vyšetření drůbeže, zejména ptáků jevících známky nemoci anebo ptáků, kteří neprospívají tak, jak by se očekávalo. |
|
c) |
Standardní vzorky se musí odebrat z drůbeže ve stáří dvou až tří týdnů. |
|
d) |
Úřední dozor nad hospodářstvím lze zrušit až po klinickém vyšetření drůbeže starší 21 dnů a při negativních výsledcích vyšetření standardních vzorků. |
8.4 Čl. 13 odst. 2 písm. b) – Odchylky týkající se určitých hospodářství
V případě, že úřední veterinární lékař provádí šetření v hospodářství, kterému byla přiznána odchylka od čl. 11 odst. 2 prvního pododstavce směrnice 2005/94/ES, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství, pokud takové záznamy existují. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy a klinického vyšetření drůbeže nebo ostatních ptáků chovaných v zajetí, zejména těch, kteří jeví známky nemoci. |
|
c) |
Místo standardních vzorků se 21 dní od data posledního pozitivního nálezu HPAI v každé produkční jednotce a pak vždy v 21denních intervalech musí pro účely laboratorního vyšetření odebrat tyto vzorky:
Příslušný orgán však na základě výsledku posouzení rizik může přiznat odchylky od velikosti vzorku, jež je uvedena v bodech i) a ii). |
|
d) |
V odběru vzorků uvedeném v písmenu c) a v laboratorním testování takových vzorků je třeba pokračovat až do doby, než se s nezbytným odstupem nejméně 21 dnů dosáhne dvou po sobě jdoucích negativních laboratorních výsledků. |
8.5 Čl. 15 odst. 1 a 3 – Opatření, která se mají použít v kontaktních hospodářstvích
V případě, že úřední veterinární lékař provádí kontrolu v kontaktním hospodářství, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství, pokud takové záznamy existují. Každodenní údaje o úmrtnosti a produkci vajec, příjmu krmiva a/nebo vody, jsou-li takové údaje k dispozici, za období začínající jeden týden před datem kontaktu s hejnem podezřelým z nákazy influenzou ptáků a končící datem inspekce hospodářství provedené úředním veterinárním lékařem je třeba doložit ve zprávě o inspekci hospodářství, kterou vypracuje úřední veterinární lékař. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy a klinického vyšetření drůbeže nebo jiných ptáků chovaných v zajetí, zejména těch, kteří jeví známky nemoci. |
|
c) |
V případě, že jsou u drůbeže nebo jiných ptáků chovaných v zajetí přítomny klinické příznaky nebo náznaky zvyšování denní úmrtnosti (více než trojnásobek normálních hodnot úmrtnosti hejna) nebo snižování denní produkce vajec (> 5 %) nebo snížení denního příjmu krmiva a/nebo vody (> 5 %), je třeba v každé produkční jednotce ihned odebrat standardní vzorky. |
|
d) |
Neexistují-li žádné známky uvedené v písmenech b) a c), je třeba 21 dní od data posledního podezřelého kontaktu s infikovaným hospodářstvím anebo v případě, že drůbež nebo jiní ptáci chovaní v zajetí byli usmrceni, odebrat standardní vzorky. |
8.6 Čl. 18 písm. b) a c) – Soupis hospodářství a kontroly úředního veterinárního lékaře a dozor v hospodářstvích v ochranném pásmu
V případě, že úřední veterinární lékař provádí kontrolu v komerčním hospodářství, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství. V případě, že jsou přítomny náznaky zvyšování denní úmrtnosti (více než trojnásobek normálních hodnot úmrtnosti hejna) nebo snižování denní produkce vajec (> 5 %) nebo snížení denního příjmu krmiva a/nebo vody (> 5 %), je třeba v každé produkční jednotce ihned odebrat standardní vzorky. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy a klinického vyšetření drůbeže a jiných ptáků chovaných v zajetí, zejména těch, kteří jeví známky nemoci. |
|
c) |
Tam, kde se neočekává, že druhy drůbeže nebo jiní ptáci chovaní v zajetí budou jevit jasné klinické příznaky onemocnění, anebo v případě, že jsou ptáci očkováni, může příslušný orgán na základě výsledku posouzení rizik rozhodnout, že se z každé produkční jednotky musí odebrat standardní vzorky. |
|
d) |
Na základě výsledků posouzení rizik musí příslušný orgán rozhodnout o dodatečném úředním dozoru cestou klinických kontrol a odběru vzorků k laboratorním testům ve vybraných hospodářstvích, úsecích nebo produkčních typech. |
8.7 Čl. 19 písm. f) – Opatření, která se mají použít v hospodářstvích v ochranných pásmech
V případě, že veterinární lékař provádí kontrolu v hospodářství, kde byla hlášena zvýšená nemocnost, úmrtnost nebo změny v údajích o produkci, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů v hospodářství. Existují-li náznaky zvýšení denní úmrtnosti (více než trojnásobek normálních hodnot míry úmrtnosti v hejnu) nebo snížení denní produkce vajec (> 5 %) nebo snížení denního příjmu krmiv a/nebo vody (> 5 %), je třeba z každé produkční jednotky odebrat standardní vzorky. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy a klinického vyšetření drůbeže nebo jiných ptáků chovaných v zajetí, zejména ptáků jevících známky nemoci. |
8.8 Čl. 23 písm. b) – Odchylky pro přímou přepravu drůbeže za účelem její okamžité porážky
V případě, že úřední veterinární lékař kontroluje hospodářství, jemuž byla přiznána odchylka od článku 22 směrnice 2005/94/ES, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy a klinického vyšetření jakékoliv drůbeže, zejména ptáků, u nichž se do 24 hodin před posláním na porážku projeví známky nemoci. |
|
c) |
Na základě výsledků posouzení rizik provedeného příslušným orgánem se místo standardních vzorků musí z každé produkční jednotky do 48 hodin před odesláním odebrat z drůbeže určené na porážku nejméně 60 tracheálních/orofaryngeálních a/nebo 60 kloakálních výtěrů. |
8.9 Čl. 25 písm.b) – Odchylky pro přímou přepravu kuřic před snáškou
V případě, že úřední veterinární lékař provádí kontrolu hospodářství, jemuž byla přiznána odchylka od článku 22, před přímou přepravou kuřic před snáškou, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy a klinického vyšetření jakékoli drůbeže, zejména ptáků, u nichž se do 24 hodin před odesláním projeví známky nemoci. |
|
c) |
Na základě výsledků hodnocení rizika provedeného příslušným orgánem se místo standardních vzorků musí z každé produkční jednotky do 48 hodin před odesláním odebrat z drůbeže určené k přepravě nejméně 60 tracheálních/orofaryngeálních a/nebo 60 kloakálních výtěrů. |
8.10 Čl. 26 odst. 1 písm. a) – Odchylka pro přímou přepravu násadových a konzumních vajec
V případě, že úřední veterinární lékař provádí kontrolu hospodářství s mateřským hejnem, jemuž byla přiznána odchylka od článku 22, před přímou přepravou násadových vajec, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství. |
|
b) |
Klinické šetření v každé produkční jednotce jednou za patnáct dní. |
|
c) |
Z každé produkční jednotky se musí odebrat standardní vzorky. |
8.11 Čl. 29 odst. 1 – Doba trvání opatření
Opatření, jež se v souladu s oddílem 3 kapitoly IV směrnice 2005/94/ES vztahují na ochranné pásmo, lze zrušit do 21 dní po provedení předběžného vyčištění a dezinfekci infikovaných hospodářství, za předpokladu, že:
|
a) |
Všechna komerční hospodářství nacházející se v ochranném pásmu zkontroloval úřední veterinární lékař a všechny kontroly a klinické inspekce a laboratorní testy, stanovené v bodě 8.6 písm. a), b) a c) a v bodě 8.7, proběhly s negativním výsledkem. |
|
b) |
Všechna identifikovaná nekomerční hospodářství v ochranném pásmu byla zkontrolována úředním veterinárním lékařem a klinické vyšetření ani výsledky kteréhokoli provedeného laboratorního testu nevedly k podezření na infekci influenzy ptáků. |
|
c) |
Výsledky jakéhokoli provedeného dodatečného úředního dozoru, stanoveného v bodě 8.6 písm. d), byly negativní. |
8.12 Čl. 30 písm. g) – Opatření, která se mají použít v pásmech dozoru
V případě, že úřední veterinární lékař provádí kontrolu hospodářství, v němž byla hlášena zvýšená nemocnost, úmrtnost nebo změny v údajích o produkci, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů v hospodářství. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy a klinického vyšetření drůbeže a jiných ptáků chovaných v zajetí, zejména těch, kteří jeví známky nemoci. |
|
c) |
Z každé produkční jednotky se musí odebrat standardní vzorky. |
8.13 Článek 35 – Šetření v případě podezření na přítomnost HPAI na jatkách a v dopravních prostředcích
V případě, že úřední veterinární lékař provádí kontrolu hospodářství, z něhož pocházejí ptáci na jatkách nebo v dopravních prostředcích, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství, pokud takové záznamy existují. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy a klinického vyšetření drůbeže nebo jiných ptáků chovaných v zajetí, s přihlédnutím ke konzultaci s úředním veterinárním lékařem na jatkách, který musí uvést podrobnosti k jakýmkoli předchozím údajům o kontrole a výsledkům vyšetření před a po smrti zvířat. |
|
c) |
Pokud příslušný orgán není přesvědčen, že podezření na přítomnost HPAI lze na základě veterinárního šetření v souladu s písmeny a) a b) vyloučit, je třeba z každé produkční jednotky odebrat standardní vzorky. |
|
d) |
Kromě standardních vzorků je třeba pro účely laboratorních testů zaslat vzorky nejméně z pěti nemocných, uhynulých nebo na jatkách poražených ptáků s patologickým nálezem. |
8.14 Čl. 36 odst. 1 – Opatření, která se mají použít na jatkách
Po skončení šetření uvedeného v bodě 8.13 a za předpokladu, že výsledky laboratorních testů jsou negativní a že v hospodářství původu ani na jatkách neexistuje žádné klinické podezření na přítomnost HPAI, lze úřední dozor zrušit.
8.15 Čl. 37 odst. 1 a 2 – Opatření, která se mají použít na stanovištích pohraniční kontroly nebo v dopravních prostředcích
|
8.15.1 |
V případě, že úřední veterinární lékař vyšetřuje drůbež nebo jiné v zajetí chované ptáky držené v izolaci, kteří byli pro podezření na HPAI nebo v důsledku jejího potvrzení přemístěni ze stanoviště pohraniční kontroly nebo z dopravního prostředku, je třeba provést tato opatření:
|
|
8.15.2 |
Jestliže úřední veterinární lékař v případě, že drůbež nebo jiní ptáci chovaní v zajetí byli poraženi, kontroluje hospodářství původu, je třeba provést tato opatření:
|
8.C Nízkopatogenní influenza ptáků (LPAI)
8.16 Čl. 39 odst. 6 písm. b) a h) – Opatření, která se mají použít v hospodářstvích s potvrzenými ohnisky LPAI
V případě, že úřední veterinární lékař kontroluje hospodářství před posláním drůbeže na jatka nebo hospodářství, v němž se nachází drůbež již vylíhnutá z vajec sebraných během doby inkubace, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy, klinického vyšetření drůbeže nebo jiných ptáků chovaných v zajetí. |
|
c) |
Standardní vzorky je třeba odebrat z ptáků z každé produkční jednotky a zaslat je do 48 hodin před datem poslání drůbeže na jatka. |
|
d) |
Standardní vzorky se musí odebrat z každé produkční jednotky z drůbeže již vylíhnuté z vajec sebraných během doby inkubace. |
8.17 Čl. 40 odst. 2 písm. b) – Odchylka pro některá hospodářství pro opatření, která se mají použít v případě potvrzených ohnisek
V případě, že úřední veterinární lékař kontroluje hospodářství, jemuž byla přiznána odchylka od čl. 39 odst. 2 a čl. 39 odst. 5 písm. b) směrnice 2005/94/ES, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství, pokud takové záznamy existují. |
|
b) |
Klinické šetření v každé produkční jednotce v pravidelných intervalech, včetně vyhodnocení její klinické anamnézy a klinických vyšetření drůbeže nebo jiných ptáků chovaných v zajetí, zejména těch, kteří jeví známky nemoci. |
|
c) |
Místo standardních vzorků se pro účely laboratorního testování musí 21 dní od data posledních pozitivních nálezů LPAI z každé produkční jednotky a dále vždy s odstupem 21 dní odebírat tyto vzorky:
Příslušný orgán však na základě výsledků posouzení rizik může přiznat odchylky od velikosti vzorku uvedené v bodech i) a ii). |
|
d) |
V odběru vzorků uvedeném v písmenu c) a laboratorním testování takových vzorků je třeba pokračovat až do doby, než se dospěje ke dvěma po sobě jdoucím negativním laboratorním výsledkům, mezi nimiž je odstup minimálně 21 dní. |
8.18 Čl. 42 odst. 1 a 3 – Opatření, která je třeba uplatnit v kontaktních hospodářstvích
V případě, že úřední veterinární lékař kontroluje kontaktní hospodářství, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů kontaktního hospodářství, pokud takové záznamy existují. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy a klinických vyšetření drůbeže nebo jiného ptactva chovaného v zajetí, zejména těch ptáků, kteří jeví známky nemoci. |
|
c) |
Standardní vzorky je třeba odebrat z každé produkční jednotky nebo v případě, že se drůbež nebo jiné ptactvo chované v zajetí utratí. |
8.19 Čl. 44 odst. 1 písm. b) – Opatření, která se mají použít v uzavřených pásmech
V případě, že úřední veterinární lékař kontroluje komerční hospodářství v uzavřeném pásmu, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy a klinických vyšetření drůbeže a jiných ptáků chovaných v zajetí, zejména ptáků, kteří jeví známky nemoci. |
|
c) |
Z každé produkční jednotky je třeba odebrat standardní vzorky. |
|
d) |
Na základě výsledků posouzení rizik musí příslušný orgán rozhodnout o dodatečném úředním dozoru cestou klinických kontrol a odběru vzorků k laboratorním testům ve vybraných hospodářstvích, úsecích nebo produkčních typech. |
8.20 Čl. 45 písm. a) a b) – Doba trvání opatření
Opatření, která se používají v uzavřeném pásmu v souladu s oddílem 3 kapitoly V směrnice 2005/94/ES, se mohou zrušit nejdříve 21 dní od data provedení předběžného vyčištění a dezinfekce infikovaného hospodářství po depopulaci hospodářství nebo nejdříve 42 dní od data potvrzení LPAI, za předpokladu, že:
|
a) |
Úřední veterinární lékař provedl ve všech komerčních hospodářstvích v uzavřeném pásmu šetření a byly provedeny a jsou dostupné veškeré laboratorní testy se vzorky uvedenými v písmenech c) a d) bodu 8.13. |
|
b) |
Jsou dostupné výsledky jakýchkoli dodatečných klinických kontrol a laboratorních testů, jež mohou zahrnovat nekomerční hospodářství, provedených za účelem stanovení rizika šíření LPAI. |
|
c) |
Příslušný orgán je na základě výsledků posouzení rizik a s přihlédnutím k epidemiologické situaci a výsledkům laboratorních testů uvedených v písmenech a) a b) přesvědčen, že riziko šíření LPAI je zanedbatelné; z takového posouzení lze vyvodit, že v případě pozitivních sérologických nálezů a negativních virologických nálezů se mohou příslušná omezení zrušit. |
8.D Opatření k zamezení přenosu virů influenzy ptačího původu na jiné druhy
8.21 Čl. 47 odst. 1 a 6 – Laboratorní testy a jiná opatření týkající se prasat a jiných druhů
V případě, že úřední veterinární lékař kontroluje hospodářství, v němž se chovají prasata, je třeba v návaznosti na potvrzení influenzy ptáků provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství, pokud takové záznamy existují. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy a klinických vyšetření prasat, zejména těch, která jeví známky nemoci. |
|
c) |
Nosní/orofaryngeální výtěry z nejméně 60 prasat z každé produkční jednotky nebo ze všech prasat v případech, kdy se v produkční jednotce nachází méně než 60 prasat, je třeba odebrat před utracením nebo v den utracení infikované drůbeže nebo jiného ptactva chovaného v zajetí. Dva až čtyři týdny od data utracení se z prasat musí odebrat alespoň 60 vzorků krve. Vzorky je třeba odebrat tak, aby se získal přinejmenším jeden vzorek ze skupiny prasat, která byla ve vzájemném přímém kontaktu. |
|
d) |
Přemístění prasat do jiných hospodářství lze povolit za předpokladu, že přinejmenším u 60 nosních/orofaryngeálních výtěrů a 60 krevních vzorků odebraných z prasat z každé produkční jednotky jsou 14 dní od data pozitivních testů na přítomnost influenzy ptáků výsledky negativní. Odeslání prasat na jatka lze povolit za předpokladu, že nejméně u 60 nosních/orofaryngeálních výtěrů z každé produkční jednotky jsou 14 dní od data pozitivních testů na přítomnost influenzy ptáků výsledky negativní. V případě neprůkazných nebo pozitivních laboratorních výsledků se požaduje jakékoliv další vyšetření k vyloučení infekce nebo přenosu influenzy ptáků mezi prasaty. |
|
e) |
V případě, že úřední veterinární lékař má podezření, že jiná domácí zvířata v hospodářství, zejména ta, u nichž se zjistila vnímavost na infekci viry AI podtypů H5 a H7, mohla být v kontaktu s infikovanou drůbeží nebo jinými ptáky chovanými v zajetí, je třeba odebrat vzorky pro účely laboratorních testů. |
8.E Repopulace
8.22 Čl. 49 odst. 3 písm. b) a c) – Repopulace hospodářství
V případě, že úřední veterinární lékař kontroluje komerční hospodářství, které bylo repopulováno, je třeba provést tato opatření:
|
a) |
Kontrolu výrobních a zdravotních záznamů hospodářství. |
|
b) |
Klinické šetření v každé produkční jednotce, včetně vyhodnocení její klinické anamnézy a klinických vyšetření drůbeže nebo jiného ptactva chovaného v zajetí, zejména ptáků, kteří jeví známky nemoci. |
|
c) |
Místo standardních vzorků je třeba z každé produkční jednotky odebrat:
|
|
d) |
Tam, kde hospodářství bylo předtím infikováno HPAI, musí se rovněž z vodního ptactva (kachny/husy) případně z každé produkční jednotky v průběhu posledního týdne časového období 21 dní od data repopulace odebrat 20 tracheálních/orofaryngeálních výtěrů a 20 kloakálních výtěrů. |
|
e) |
V případě, že hospodářství bylo předtím infikováno LPAI, musí se z každé produkční jednotky odebrat 20 tracheálních/orofaryngeálních výtěrů, 20 kloakálních výtěrů a 20 krevních vzorků. |
8.F Očkování
8.23 Čl. 56 odst. 2 písm. i) – Preventivní očkování drůbeže nebo jiného ptactva chovaného v zajetí
Laboratorní testy uvedené v kapitole IX směrnice 2005/94/ES se musí provádět s očkovanou drůbeží nebo jiným ptactvem chovaným v zajetí, s použitím testů v souladu se strategií DIVA (strategie odlišení infikovaného zvířete od očkovaného) v případě, že volně vyskytující se virus je znám.
Používá-li se sentinelových ptáků, musí být přítomni v každém očkovaném hejnu, klinicky vyšetřeném a testovaném s použitím hemaglutinačně inhibičního testu (HI). Pro tento účel se alespoň každých 60 dní musí neočkovaným sentinelovým ptákům v každém očkovaném hospodářství odebírat 20 krevních vzorků.
8.24 Příloha IX – Požadavky týkající se pohybu drůbeže nebo jiného ptactva chovaného v zajetí a drůbežích produktů, použitelné v souvislosti s nouzovým očkováním
Na pohyb živé drůbeže nebo jiného ptactva chovaného v zajetí a jejich vajec se v zájmu minimalizace rizika dalšího šíření infekce influenzy ptáků musí použít přísná monitorovací opatření.
Pro tento účel se na počátku kampaně nouzového očkování musí ve vztahu k pohybu živé drůbeže a jiného ptactva chovaného v zajetí a jejich vajec použít stejných monitorovacích opatření, v zájmu minimalizace rizika a dalšího šíření infekce influenzy ptáků uvnitř a mimo oblast očkování.
|
a) |
Úřední veterinární lékař musí před prvním pohybem násadových a konzumních vajec a následně minimálně každých 30 dní provádět tato opatření:
|
|
b) |
Pro účely pohybu živé očkované drůbeže nebo jiného ptactva chovaného v zajetí do jiných hospodářství nebo pohybu živé očkované drůbeže uvnitř a mimo oblast očkování musí úřední veterinární lékař provést tato opatření:
|
KAPITOLA V
Diagnostické virologické testy a vyhodnocení výsledků
|
1. |
Až do nástupu a rozvoje testů na molekulární bázi se izolace viru inokulací do alantoidní dutiny kuřecích zárodků považovala za zdaleka nejcitlivější diagnostický test na influenzu ptáků, se zásadním významem pro následnou identifikaci a charakterizaci infikujícího viru. Základní kroky jsou nastíněny v této kapitole. |
2. Zpracování vzorku
Pokud se výtěry zašlou „suché“, musí se vložit do postačujícího antibiotického média, aby byly zcela ponořeny. Vzorky se mohou slučovat do skupin po pěti, pocházejí-li od téhož druhu, jsou z téže doby a ze stejné epidemiologické jednotky.
Kadávery zaslané do laboratoře se musí podrobit pitvě, přičemž je třeba odebrat vzorky těchto orgánů: výkaly nebo střevní obsah, mozková tkáň, průdušnice, plíce, játra, slezina a ostatní zjevně postižené orgány. Tyto orgány a tkáně se mohou sloučit, zásadní je však oddělené zpracování fekálního materiálu.
Vzorky trusu a orgány se musí homogenizovat (v uzavřeném mixéru nebo s použitím paličky, hmoždíře a sterilního písku) v antibiotickém médiu, aby se v médiu vytvořilo 10 až 20 hmotnostních/objemových procent suspenzí.
Ponořené výtěry a suspenze se musí ponechat asi dvě hodiny při pokojové teplotě (anebo delší dobu při teplotě 4 °C) a pak vyčeřit odstředěním (například 800 až 1 000 x g po dobu 10 minut).
3. Izolace viru v kuřecích zárodcích
0,1–0,2 ml odstředěného supernatantu se inokuluje do alantoidní dutiny nejméně čtyř kuřecích zárodků inkubovaných 9 až 11 dnů. V ideálním případě by měla vejce pocházet z hejna, kde nebyly odhaleny specifické patogeny (SPF hejno). Pokud to však není možné, připouští se použití vajec z hejna, u kterého bylo potvrzeno, že je prosté protilátek na AI (SAN hejno).
Inokulované zárodky se inkubují při teplotě 37 °C a denně se prohlížejí prosvícením. Postupně je třeba všechna vejce s mrtvými a umírajícími zárodky a všechna vejce, která zbyla po šesti dnech od inokulace, ochladit na 4 °C a v alantoidní/amniotické tekutině zjišťovat přítomnost hemaglutininů. Nedošlo-li k hemaglutinaci, musí se celý postup opakovat s použitím neředěné alantoidní/amniotické tekutiny jako inokulátu. Jestliže k hemaglutinaci došlo, je třeba kultivací vyloučit přítomnost bakterií. Je-li zjištěna přítomnost bakterií, připouští se přefiltrování tekutin přes filtr s membránou 450 nm, poté se přidají další antibiotika a provede se inokulace kuřecích zárodků výše uvedeným způsobem.
Aby laboratoře diagnózu urychlily, použily některé z nich dvou třídenních pasáží nebo dvoudenní a čtyřdenní pasáže a u dvou šestidenních pasáží dospěly ke srovnatelným výsledkům; úplné vyhodnocení však dosud chybí.
Pozitivní tekutiny je třeba testovat na nepřítomnost bakterií. V případě jejich přítomnosti se tekutiny mohou přefiltrovat přes filtr s membránou 450 nm nebo odstředit, aby se odstranily bakterie, a po přidání antibiotik se mohly repasážovat do vajec.
4. Diferenciální diagnóza
|
a) |
Předběžná diferenciace Vzhledem k tomu, že je třeba co nejrychleji zavést opatření pro tlumení influenzy ptáků s cílem zamezit dalšímu šíření viru, každá národní referenční laboratoř, která izolovala virus vyvolávající hemaglutinaci, by měla být schopna určit, zda se jedná o virus influenzy typu A podtypů H5 nebo H7 anebo o virus newcastleské choroby. Hemaglutinující tekutiny se musí použít při hemaglutinačně inhibičních testech popsaných v kapitole IX. Pozitivní inhibice, tj. titr v rozmezí 2–3 log2 u pozitivních kontrol, s pomocí polyklonálních antisér podtypů H5 nebo H7 u influenzy typu A, může sloužit k předběžné identifikaci viru, aby mohla být zavedena dočasná opatření pro tlumení. |
|
b) |
Průkaz viru Vzhledem k tomu, že u chřipkových virů existuje 16 podtypů hemaglutininu a 9 podtypů neuraminidázy, přičemž každý z těchto podtypů vykazuje ještě různé variace, není možné ani rentabilní, aby každá národní referenční laboratoř uchovávala antiséra, jež by umožňovala kompletní antigenní charakteristiku chřipkových izolátů. Každá národní referenční laboratoř však minimálně musí:
Kromě toho je potřebné, aby laboratoře s odpovídajícím vybavením:
Národní referenční laboratoře musí rovněž uvážit nasazení odbornosti a vybavení, které umožní sekvencování nukleotidů genu hemaglutininu, aby se určilo, zda jsou či nejsou přítomny mnohočetné bazické aminokyseliny v restrikčním místě bílkovinného prekursoru hemaglutininu pro kterýkoli LPAI H5 nebo H7 virus. I když referenční laboratoř Společenství bude provádět stanovení patogenity jako jednu ze svých priorit a součást úkolů uvedených v příloze VII bod 2 písm. b) směrnice 2005/94/ES, charakterizace viru na národní úrovni značně zkrátí dobu potřebnou k diagnóze, a v případě pozitivního výsledku i dobu nutnou k plnému zavedení opatření pro tlumení HPAI. |
|
c) |
Další typizace a charakterizace izolátů Referenční laboratoř Společenství musí z národních referenčních laboratoří obdržet všechny viry vyvolávající hemaglutinaci k dalšímu zkoumání antigenních a genetických aspektů, aby se lépe porozumělo epizootologii nemoci/nemocí v rámci Společenství, v souladu s pravomocemi a úkoly referenční laboratoře Společenství, jak jsou stanoveny v příloze VII směrnice 2005/94/ES. Kromě těchto pravomocí a úkolů referenční laboratoř Společenství musí provádět i kompletní antigenní typizaci všech obdržených virů. Pokud jde o viry H5 a H7, u nichž je ukazatel intravenózní patogenity nižší než 1,2, musí se i u nich provést sekvencování nukleotidů genu hemaglutininu, aby se určilo, zda jsou či nejsou přítomny mnohočetné bazické aminokyseliny v restrikčním místě bílkovinného prekursoru hemaglutininu, a národní referenční laboratoř a příslušný orgán v zemi původu musí být příslušně informovány, jakmile výsledky budou k dispozici, aby se mohla plně zavést opatření pro tlumení HPAI. |
|
d) |
S ohledem na měnící se epidemiologickou situaci, pokud jde o HPAI/LPAI, by mohlo být možné dosáhnout na základě dohody jak s Komisí, tak s referenční laboratoří Společenství přiznání odchylky laboratořím s plnými kapacitami pro rychlou charakterizaci viru, aby po přezkoumání dat zaslaly podsoubory těchto virů a referenční laboratoř Společenství pak mohla provést relevantní výběr. Tato odchylka by se měla přiznat pouze v případě, že národní referenční laboratoř je schopna data rychle generovat a sdílet je s referenční laboratoří Společenství. |
KAPITOLA VI
Molekulární testy a vyhodnocení výsledků
Současná definice HPAI umožňuje molekulární identifikaci faktorů virulence a potvrzuje použití molekulárních technik v diagnóze influenzy ptáků. V poslední době došlo k posunu v jejich aplikaci při odhalování a charakterizaci viru influenzy ptáků přímo z klinických vzorků odebraných z infikovaných ptáků. Konvenční RT-PCR techniky u klinických vzorků by při správně definovaných primerech mohly vést k rychlé detekci a identifikaci podtypu (přinejmenším H5 a H7), a PCR amplicon produkt by se mohl použít při sekvencování nukleotidů – také se již prokázal význam jeho aplikace při rychlé identifikaci následných ohnisek, jakmile se odhalí primárně infikované prostory a virus je charakterizován. Test RT-PCR spočívající v jednom kroku a uskutečnitelný v „reálném čase“, při němž se používá systémů primeru/fluorogenní zkoušky (test rRT-PCR), umožňuje dokonce ještě rychlejší a citlivější diagnózu s detekcí virů influenzy ptáků a stanovením podtypů H5 nebo H7 v klinických vzorcích.
Nemalým problémem je v případě systémů RT-PCR a rRT-PCR okolnost, že až dosud byly v různých laboratořích vyvinuty odlišné systémy, které přesto, že jsou zcela legitimní, nebyly validovány ani podrobeny testům s velkým počtem vzorků v různých laboratořích. Referenční laboratoř Společenství a specifikované národní referenční laboratoře tento problém řeší jako součást projektu financovaného Společenstvím (EU AVIFLU), sledujícího vypracování ratifikovaných protokolů pro konvenční testy RT-PCR a rRT-PCR, které by ostatní národní referenční laboratoře mohly přijmout. Jestliže se parametry testu, jako jsou doby cyklování a časového sledu, budou odchylovat od parametrů doporučených ve specifikovaných protokolech, musí se ještě před použitím v souladu s odstavcem 6 kapitoly I této diagnostické příručky prokázat, že jsou pro daný účel vhodné.
Standardní protokoly pro tyto molekulární testy a jejich vyhodnocování, používané referenční laboratoří Společenství, jsou dostupné na této internetové stránce:
http://www.defra.gov.uk/corporate/vla/science/science-viral-ai-reflab.htm.
KAPITOLA VII
In vivo test patogenity a vyhodnocení výsledků
Virulenci virů influenzy typu A pro kuřata, izolovaných z ptáků, je třeba stanovit s použitím testu ukazatele intravenózní patogenity (IVPI), který se musí provést takto:
|
a) |
Čerstvě infikovaná alantoidní tekutina s HA titrem > 1/16 (> 24 nebo > log2 4, vyjádří-li se jako převrácená hodnota) z nejnižší dostupné úrovně pasáže, přednostně z původní izolace bez jakéhokoli výběru, je zředěna v poměru 1/10 ve sterilním izotonickém fyziologickém roztoku. |
|
b) |
0,1 ml virové suspenze se nitrožilně podá deseti šestitýdenním SPF nebo SAN kuřatům. |
|
c) |
Pokusná kuřata se kontrolují každých 24 hodin po dobu deseti dnů. Při každé kontrole se každému kuřeti přidělí jedno z následujících skóre: 0 = normální, 1 = nemocné, 2 = vážně nemocné, 3 = mrtvé. Označení kuřete za nemocné a vážně nemocné je subjektivním klinickým hodnocením. Za normálních okolností vykazují „nemocná“ kuřata jeden z následujících příznaků a „závažně nemocná“ kuřata více než jeden z následujících příznaků: postižení dýchacího ústrojí, otupělost, průjmy, cyanózu exponované kůže nebo lalůčku, edém obličejové části a/nebo hlavy, neurologické příznaky. Mrtvým ptákům se musí přidělit skóre 3 při každém ze zbývajících každodenních pozorování po úhynu. Z důvodů dobrých životních podmínek zvířat je třeba kuřata nemocná natolik, že nemohou přijímat potravu nebo vodu, šetrně utratit a při další kontrole je hodnotit jako mrtvá, protože bez zásahu uhynou do 24 hodin. Tento přístup je pro akreditační orgány přijatelný. |
|
d) |
IVPI je průměrné skóre na pokusné kuře a na jedno pozorování za období 10 dnů. Ukazatel 3,00 znamená, že všechna kuřata uhynula do 24 hodin, a ukazatel 0,00 zase vyjadřuje, že u žádného kuřete se v průběhu desetidenního pozorování neprojevily žádné klinické příznaky. |
V níže uvedeném příkladu je znázorněna jednoduchá metoda evidence výsledků a výpočtu ukazatelů:
|
Klinické příznaky |
Den po inokulaci |
Celkové skóre |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||
|
Normální |
10 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
12 x 0 = 0 |
|
Nemocné |
0 |
4 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
6 x 1 = 6 |
|
Vážně nemocné |
0 |
2 |
2 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
6 x 2 = 12 |
|
Mrtvé |
0 |
2 |
6 |
8 |
10 |
10 |
10 |
10 |
10 |
10 |
76 x 3 = 228 |
|
|
|
|
|
|
|
|
|
|
|
|
Celkem = 246 |
Poznámky:
10 kuřat pozorováno po dobu deseti dnů = 100 pozorování
Ukazatel = průměrné skóre na pokusné kuře a na jedno pozorování = 246/100 = 2,46
Kterýkoli virus influenzy typu A bez ohledu na jeho podtyp, vykazující při testu IVPI hodnotu větší než 1,2, je považován za HPAI virus.
KAPITOLA VIII
Sérologické testy a vyhodnocení výsledků
Při prokazování přítomnosti viru influenzy typu A se upřednostňuje metoda, která dokazuje, že nukleová kyselina a bílkovina nebo matrixové antigeny jsou společné všem virům influenzy typu A.
Lze ji použít při dvojitých imunodifúzních testech, zahrnujících buď koncentrované virové suspenze nebo extrakty z infikovaných chorioalantoidních membrán.
Upřednostňovanými metodami používanými při sérologických testech na protilátky viru influenzy ptáků jsou hemaglutinační test (HA) a hemaglutinačně inhibiční test (HI).
Kapitola 2.7.12 Příručky norem pro diagnostické testy a očkovací látky pro suchozemská zvířata Světové organizace pro zdraví zvířat (OIE) obsahuje podrobné informace o laboratorních technikách a hodnocení výsledků.
Standardní protokoly pro sérologické testy a hodnocení jejich výsledků, používané referenční laboratoří Společenství, jsou dostupné na této internetové stránce:
http://www.defra.gov.uk/corporate/vla/science/science-viral-ai-reflab.htm.
KAPITOLA IX
Monitorovací systémy spojené s očkováním
1. Směrnice 2005/94/ES a diagnostická příručka
Oddíly 2 a 3 kapitoly IX směrnice 2005/94/ES umožňují za určitých podmínek použití nouzového a preventivního očkování. Jednou z těchto podmínek je, že se musí použít strategie DIVA (odlišení infikovaného zvířete od očkovaného).
Očkování se musí zaměřit na prevenci infekce a následného šíření viru mezi hejny. Existuje nepopiratelný důkaz, že očkováním se zvyšuje množství viru potřebného k nakažení ptáků a naopak snižuje množství vylučovaného viru. Přestože očkovaní ptáci již dále nevykazují klinické příznaky, mohou při setkání s nákazou virus dále šířit. HPAI viry podtypů H5 a H7 by mohly nepozorovaně po určitou dobu cirkulovat v hejnu se suboptimální imunitou stejným způsobem, jakým by mohly cirkulovat LPAI viry v neočkovaném hejnu. Proto je nezbytné umět identifikovat očkovaná hejna pozitivní na virus, která se infikovala volně se vyskytujícím virem, aby se mohla zavést jiná kontrolní opatření, jako je například eradikace.
2. Použití sentinelových ptáků pro monitorování infekce
Na úrovni hejna je jednoduchou metodou pravidelné monitorování sentinelových ptáků ponechaných bez očkování v každém očkovaném hejnu, tento přístup však naráží na některé problémy s řízením, zejména při identifikaci sentinelových ptáků, obzvlášť ve velkých hejnech. Musí být zajištěn kontakt mezi sentinelovými a očkovanými ptáky.
3. Laboratorní test DIVA pro účely monitorování infekce
Alternativou nebo rozšířením testování na přirozenou expozici mohou být laboratorní testy DIVA prováděné u očkovaných ptáků. V posledních letech bylo vyvinuto několik systémů testování, které rovněž umožňují detekci expozice očkovaných ptáků volně se vyskytujícímu viru. Jednou z metod, která se osvědčila jako proveditelná, je použití očkovací látky obsahující virus téhož podtypu hemaglutininu (H) jako u převažujícího volně se vyskytujícího viru, avšak s odlišnou neuraminidázou (N). Protilátky proti N volně se vyskytujícího viru sehrávají roli přirozených markerů infekce.
Tohoto systému se použilo v Itálii po znovuobjevení viru LPAI H7N1 v roce 2000. Jako doplněk přímých opatření pro tlumení byla zavedena strategie DIVA s použitím očkovací látky obsahující H7N3 k potírání infekce volně se vyskytujícím virem H7N1. Očkovaní ptáci a ptáci exponovaní volně se vyskytujícímu viru se rozlišovali s použitím sérologického testu na detekci specifických anti-N1 protilátek. Stejné strategie se použilo pro tlumení LPAI, vyvolané v Itálii v letech 2002–2003 virem H7N3, v tomto případě pomocí vakcíny obsahující H7N1 a sérologického testu detekujícího specificky protilátky proti N3. V obou případech očkování spolu s vymýcením za použití této strategie DIVA mělo za následek eradikaci volně se vyskytujícího viru.
Problémy s tímto systémem nastanou v případě, že se objeví volně se vyskytující virus, který má stejný N antigen jako existující volně se vyskytující virus, avšak je jiného H podtypu než H5 nebo H7, anebo v případě, že podtypy se stejnými N antigeny již volně cirkulují. Známými přenašeči více než jednoho podtypu jsou zejména kachny. Vyvstala rovněž potřeba vyvinout vhodný test, kterým by se umožnilo rutinní monitorování hejn na přítomnost protilátek proti neuraminidáze. V Itálii byl vyvinut a používal se ad hoc sérologický test, založený na nepřímém testu fluorescenční protilátky, s použitím N proteinů exprimovaných rekombinanty baculoviru jako antigenu. V případě, že se vyvine ELISA test, může mít tento test širší a jednodušší použití.
Použitím vakcín obsahujících pouze HA, jako jsou rekombinantní vektorové vakcíny, se umožňují klasické AGID nebo ELISA testy, založené na nukleové kyselině a proteinu, nestrukturálním proteinu nebo matrixových bílkovinách, pro odhalování infekce u očkovaných ptáků.
Pokud jde o inaktivované vakcíny, je popsán test, kterým se odhalují protilátky proti nestrukturální virové bílkovině, tvořící se během přirozené infekce. Takový systém se v praxi musí ještě validovat, je však omezen tím, že přirozená infekce hejna jakýmkoli chřipkovým virem vede bez ohledu na podtyp k tvorbě protilátek namířených proti nestrukturální bílkovině.
Vývoj rychlých a citlivých metod k odhalování viru, zejména těch, které lze automatizovat, jako je test RT-PCR v reálném čase, dává tušit, že by se jich mohlo využít k jednoduchému širokému a pravidelnému testování očkovaných ptáků na přítomnost volně se vyskytujícího viru. Detekce původce však bude v akutní fázi infekce velice omezena a nelze z ní odvodit, že hejno v minulosti nebylo viru exponováno. Tento přístup je vhodnější pro testování očkovaných ptáků ještě před jejich pohybem, aby se prokázalo, že jsou prosti aktivní infekce.
Počtem vzorků, které se mají testovat pomocí systémů volby, se musí umožnit, aby se v hejnu s 95 % úrovní spolehlivosti vyloučila prevalence infekce virem influenzy ptáků, přesahující 15 %.
KAPITOLA X
Strategie diagnostiky influenzy ptáků
Jak je uvedeno v příloze IV směrnice 2005/94/ES, rozhodnutí o použití opatření ve specifických oblastech nebo kontaktních hospodářstvích a závažnost těchto opatření se mohou velice lišit v závislosti na míře rizika. Obdobně i požadované diagnostické potvrzení nemoci musí být asi vyváženo podle převažující situace, velikosti nebezpečí a stupně rizika. Veterinární orgány musí přijímat taková rozhodnutí o diagnostickém důkazu, jež navozují určitou vyváženost mezi rychlým tlumením a eradikací nemoci na straně jedné a potenciálními dopady mylné diagnózy na straně druhé. Taková rozhodnutí je třeba přijímat na pozadí řady faktorů až v daném okamžiku, určité situace však lze předvídat.
|
Stav onemocnění |
Potenciální problém |
Diagnostická kritéria |
|
Žádné zvláštní příznaky, žádné oficiální podezření |
Izolované hospodářství |
Provést rychlé odhalení na základě testu M genu RT-PCR. Diferenciální diagnóza podle potřeby. |
|
Primární podezřelé ohnisko |
Izolované hospodářství |
Provést úplné diagnostické testování, izolaci a charakterizaci viru. |
|
Primární podezřelé ohnisko |
Hospodářství v hustě osídlené drůbežářské oblasti |
Provést úplné diagnostické testování, izolaci a charakterizaci viru, zaměřit se však na metody rychlé detekce a charakterizace, zejména na ty, jež jsou založeny na testu RT-PCR a sekvencování (1). |
|
Druhá a následná podezřelá ohniska |
Izolovaná hospodářství, epidemiologicky propojená s primárním podezřelým ohniskem |
Zaměřit se na metody rychlého odhalení a charakterizace, zejména na ty, jež jsou založeny na testu RT-PCR a sekvencování (1). |
|
Druhá a následná podezřelá ohniska |
Hospodářství v hustě osídlené drůbežářské oblasti nebo s mnoha epidemiologickými vazbami |
Spoléhat na metody rychlého odhalení, jež vedou k nejrychlejšímu průkazu přítomnosti kteréhokoli viru influenzy ptáků (1). |
|
Vícenásobná podezřelá ohniska nebo rychle se šířící onemocnění včetně dozoru |
Šíření bude bez rychlého zásahu nekontrolovatelné |
Spoléhat na metody rychlého odhalení, jež vedou k nejrychlejšímu průkazu přítomnosti kteréhokoli viru influenzy ptáků nebo spoléhat na klinické příznaky (1). |
KAPITOLA XI
Diagnóza infekce viry influenzy ptáků u prasat a ostatních savců
1. Influenza ptáků u prasat
Viry influenzy ptáků snadno infikují prasata a i když je jejich replikace ve většině případů relativně omezena, existuje pravděpodobnost přenosu nákazy z infikovaných prasat na drůbež a jiná vnímavá zvířata. Zatím v praxi neexistují žádné důkazy, že infikovaná prasata přenášejí viry influenzy ptáků podtypů H5 a H7.
Zkušenosti získané při vzplanutí infekce v Nizozemsku v roce 2003 ukázaly, že prasata infikovaná virem H7N7 nevykazují klinické příznaky, jež by se daly přičíst nákaze tímto H7N7. Kromě toho zatím patrně nebyly hlášeny žádné případy onemocnění prasat v souvislosti s ohnisky H5N1 v Asii a jinde.
Není možné se tedy spoléhat na to, že klinické příznaky svědčí o nákaze prasat, i když lze klinický obraz vyvolaný u prasat infekcí jinými chřipkovými viry ptačího původu pozorovat v těch případech, kdy se virus přizpůsobil hostiteli. Diagnóza infekcí prasat způsobených virem AI je v zásadě obdobou diagnózy u ptačích druhů, a opírá se o izolaci viru, molekulární techniky a odhalení specifických protilátek s použitím hemaglutinačně inhibičních testů. Existují však určité rozdíly a žádný z testů není plně validovaný pro použití u prasat k potvrzení infekce vyvolané viry influenzy ptáků.
2. Vzorky pro izolaci viru
Infekce prasat vyvolané virem influenzy ptáků se obvykle omezují na dýchací ústrojí, a proto je třeba odebrat vzorky z dýchacího ústrojí a případně provést orofaryngeální nebo nosní výtěry, nejlépe u prasat vykazujících příznaky tohoto onemocnění. Tyto vzorky a výtěry se mohou zpracovat za účelem izolace viru nebo molekulární detekce viru, s použitím stejných technik, jaké jsou popsány výše pro vzorky odebrané z ptáků. Při aplikaci PCR technik se však musí použít správných kontrolních vzorků, a zajistit tak, že amplifikace nebude inhibována látkami obsaženými ve vzorcích odebraných z prasat.
3. Inokulace a inkubace vajec
Za účelem izolace virů savčí chřipky v kuřecích zárodcích inkubovaných 9 až 11 dnů se obvykle provádí inokulace do alantoidní i amniotické dutiny. Při testování prasat, která byla v kontaktu s viry influenzy ptáků, a virus měl jenom malou možnost se adaptovat, však pravděpodobně postačí pouze inokulace do alantoidní dutiny.
Obdobně se pro izolaci virů savčí influenzy typu A většinou doporučuje inkubační teplota 35 °C, v případě virů nedostatečně adaptovaných na prasata však při izolaci neuškodí teplota ve výši 37 °C.
4. Test na specifické protilátky u HI testů
Při určování infekcí způsobených u prasat virem influenzy ptáků je pravděpodobně nejcitlivější metodou izolace viru nebo molekulární detekce. Sérologická odpověď se však u prasat detekovala i při absenci izolace nebo detekce viru. HI testy používající prasečí séra vyžadují v porovnání s testem používaným pro ptačí séra, uvedeným v kapitole VIII, některé úpravy.
Prasečí séra jsou obecně známa svou schopností nespecifické inhibice v HI testech, a proto se každý vzorek séra musí ošetřit enzymem destruujícím receptor (RDE), aby se této inhibici zabránilo. Je třeba postupovat podle této metody:
|
a) |
Ke 100 μl prasečího antiséra přidat 400 μl RDE (předem stanovené pracovní ředění) a důkladně promíchat. |
|
b) |
Inkubovat při teplotě 37 °C po dobu jedné hodiny. |
|
c) |
Poté inkubovat 30 minut při teplotě 56 °C. |
|
d) |
Minimálně 15 minut chladit vzorky při teplotě 4 °C. |
|
e) |
Přidat 10 μl 30 % (v/v sediment oddělený od plasmy) kuřecích červených krvinek a důkladně promíchat. |
|
f) |
Inkubovat přes noc při teplotě 4 °C, anebo v případě, že je nezbytné, aby se vzorky použily ještě téhož dne, inkubovat při teplotě 37 °C po dobu jedné hodiny a odstřeďovat po dobu pěti minut (300 x g). |
Ošetřené sérum se pak použije u HI testů popsaných pro ptačí séra v odstavci [..], výchozí ředění je 1:10. K hodnocení specifičnosti HI testu pro kmen viru, který se má použít (viz použití kmene viru pocházejícího z ohniska pro účely sérologického vyšetření; kapitola VIII), se musí použít sada prasečích sér se známým séronegativním statusem ohledně influenzy ptáků. Při vzplanutí infekce v Nizozemsku v roce 2003 bylo při HI testu s použitím prasečích sér odebraných nezávisle na ohnisku zjištěno až 2,6 % nespecifických reagentů.
5. Odebírání vzorků od prasat
Zejména na farmách, kde se chovají smíšeně nebo v oddělených stájích prasata i drůbež, jsou prasata vystavena riziku nákazy influenzy ptáků cestou přímého nebo nepřímého kontaktu s drůbeží nebo drůbežími produkty. Aby se taková infekce vyloučila, je třeba v souladu s postupy popsanými v bodě 8.21 kapitoly IV odebrat orofaryngeální nebo nosní výtěry a krevní vzorky. Vzorky je třeba odebrat prasatům, která vykazují klinické příznaky onemocnění. V případě, že prasata nevykazují žádné klinické příznaky, vzorky se však mohou odebírat náhodně ve všech úsecích stáje. Pokud jsou výtěry k dispozici v laboratoři, musí se testovat pomocí rychlých molekulárních testů a/nebo izolací viru. Testy RT-PCR musí být řádně validovány a vykazovat citlivost přinejmenším rovnocennou s izolací viru v kuřecích zárodcích, v případě virů influenzy typu A.
Dva až čtyři týdny po utracení drůbeže infikované influenzou ptáků se prasatům musí odebrat alespoň 60 krevních vzorků tak, že přinejmenším některé vzorky se odeberou ze skupin prasat, jež jsou v přímém vzájemném kontaktu. Vzorky se musí testovat HI testem, s použitím viru pocházejícího z ohniska drůbeží nákazy. V témže testu se musí testovat vzorky z akutní i rekonvalescentní fáze. Pozitivní vzorky lze potvrdit s použitím neutralizace viru a/nebo Western blot analýz.
V případě pozitivity testu u kteréhokoli z těchto vzorků je třeba provést epidemiologické šetření ve všech prasečích farmách nacházejících se v ochranném pásmu, bez ohledu na to, zda jsou či nejsou smíšeného typu.
6. Viry influenzy ptáků u jiných savců než prasat
Musí se provést vyšetření jiných savců než prasat, vnímavých na influenzu ptáků, včetně koček. Se zvláštním poukazem na HPAI H5N1 je při testování koček třeba provést následující:
Větší patologické léze spojené s replikací viru se soustřeďují v plicích a játrech, a proto se z uhynulých zvířat musí k virologickému vyšetření přednostně odebrat vzorky těchto orgánů. U žijících zvířat se k odhalení viru musí přednostně odebrat tracheální/orofaryngeální výtěry. Kromě toho lze zvlášť odebrat fekální výtěry.
Krevní vzorky, jež je třeba vyšetřit pomocí HI testů, vyžadují tepelné ošetření při 56 °C po dobu 30 minut, přičemž aplikaci RDE lze vynechat.
KAPITOLA XII
Minimální bezpečnostní požadavky na přepravu vzorků
|
1. |
Přeprava vzorků, o nichž je známo, že obsahují patogeny, anebo u nichž je podezření na jejich přítomnost, podléhají přísným vnitrostátním a mezinárodním předpisům, jež je třeba vždy dodržet. Izoláty viru nejsou klasifikovány jako diagnostické vzorky, musí však byl baleny v souladu s mezinárodními standardy. Pokyny uvedené v této kapitole se týkají letecké přepravy, podobný obal je však třeba použít i pro pozemní nebo námořní přepravu vzorků. |
2. Balení diagnostických vzorků určených pro přepravu
Diagnostickým vzorkům přepravovaným podle předpisů IATA se přiřadí odpovídající UN identifikační číslo 2814, 2900 nebo 3373.
Dopravce, nikoli přepravní společnost, odpovídá za přepravu zásilky po celou dobu až do okamžiku jejího doručení adresátovi.
3. Primární obal
|
a) |
Primární nádoba/y musí být vodotěsná/é, například šroubové uzávěry musí být zapečetěny parafilmem nebo lepicí páskou anebo se musí chránit podobným způsobem. |
|
b) |
V případě, že jsou primární nádoby ve větším počtu, musí se jednotlivě zabalit, aby se uchránily před rozbitím. |
|
c) |
Při stanovení objemu zasílaných diagnostických vzorků se musí přihlížet k virovým přepravním médiím. |
|
d) |
Primární nádoba/y nesmí obsahovat více než 500 ml nebo 500 g vzorku. |
Celkový obsah primární nádoby tvoří diagnostický vzorek.
4. Sekundární obal
|
a) |
V sekundárním kontejneru musí být dostatek absorpčního materiálu schopného v případě úniku nebo poškození absorbovat celý obsah všech primárních nádob. |
|
b) |
Sekundární obal musí splňovat požadavky IATA na diagnostické vzorky, včetně požadavku, aby odolal pádu z výšky 1,2 m (3,9 stopy). Protože obal infekční látky překračuje požadavky na balení diagnostických vzorků uvedené v Balicím nařízení IATA 602, lze tento obal použít. |
|
c) |
Na obalu infekční látky musí být požadované označení specifikace (se zakroužkovaným „UN“): například „UN 4G/CLASS 6.2/99/GB/2450“. |
|
d) |
Sekundární obal musí být vodotěsný. Je třeba řídit se pokyny výrobce obalu nebo pokyny autorizované strany o obalu, včetně sekundárního. |
|
e) |
Nejmenší celkový vnější rozměr sekundárního obalu musí dosahovat nejméně 100 mm (čtyři palce). |
|
f) |
Sekundární obal musí byl dostatečně velký, aby se do něho mohly vložit průvodní doklady, například letecký nákladní list. |
5. Vnější obal
|
a) |
Vnější obal nesmí obsahovat více než 4 litry nebo 4 kg vzorků. |
|
b) |
V případě, že se to požaduje, musí být vnější balení obloženo suchým nebo mokrým ledem. Použije-li se suchý led, balení musí umožňovat, aby mohl volně unikat oxid uhličitý a nevznikal tlak, jehož působením by balení mohlo prasknout. Použije-li se mokrý led, musí být balení nepropustné. Každé balení a letecký nákladní list musí být doslovně označeny takto: „UN 3373 DIAGNOSTICKÝ VZOREK BALENÍ V SOULADU S IATA BALICÍM NAŘÍZENÍM 650“. |
|
c) |
Mezi sekundární obal a vnější balení se musí vložit rozepsaný seznam položek tvořících obsah zásilky. |
|
d) |
Vnější balení se musí vložit do zaplombovaného plastikového vaku k ochraně před vlhkostí. |
|
e) |
Nepožaduje se prohlášení dopravce o nebezpečném zboží. |
KAPITOLA XIII
Odeslání virů a vzorků do referenční laboratoře Společenství
|
1. |
Vzorky, které se mají zaslat do referenční laboratoře Společenství, musí splňovat doporučení pro přepravu nebezpečných patogenů v rámci Společenství a vyhovovat rovněž platným předpisům a legislativě ve Spojeném království. Je třeba řídit se pokyny uvedenými v této kapitole. |
2. Odeslání virů a jiných materiálů do referenční laboratoře Společenství
|
a) |
Veškeré materiály se musí zabalit v souladu s pokyny uvedenými v této kapitole. |
|
b) |
Vnější obal je třeba označit takto: „ZVÍŘECÍ PATOGEN – ZÁSILKU OTEVŘÍT AŽ V SEKCI PTAČÍ VIROLOGIE, VLA, WEYBRIDGE. DOVOZ JE POVOLEN POD LICENČNÍM ČÍSLEM ....*...... VYSTAVENÝM PODLE NAŘÍZENÍ O DOVOZU ZVÍŘECÍCH PATOGENŮ.“ |
|
c) |
Musí se doplnit jedno z těchto licenčních čísel:
Protože se tato licenční čísla čas od času mění, laboratoře zasílající vzorky musí před odesláním zásilek zajistit, že použijí aktuální licenční čísla. |
|
d) |
Zásilku je třeba odeslat na adresu:
|
|
e) |
V průvodním dopise k balíčku je třeba uvést co možná nejvíce údajů o izolátech, jako je druh a věk, oblast/země izolace a jakákoli klinická anamnéza. |
|
f) |
Zásilky se musí odeslat leteckou poštou nebo leteckou nákladní dopravou. Jestliže se zásilky posílají leteckou nákladní dopravou, je třeba referenční laboratoři Společenství před doručením materiálu nahlásit faxem, telefonicky nebo elektronickou poštou číslo nákladního listu letecké zásilky. Zásilky posílané leteckou nákladní dopravou se musí jasně označit takto: „CARE OF TRANSGLOBAL“, aby se na letišti zajistilo rychlé odbavení zásilky transglobálního významu. Kontakt na referenční laboratoř Společenství
|
KAPITOLA XIV
Minimální požadavky na bezpečnost diagnostických laboratoří AI
|
1. |
Požadavky na bezpečnost diagnostických laboratoří zacházejících s viry influenzy ptáků musí zahrnovat jak zabezpečení virů jako hrozby pro zdraví zvířat, tak i ochranu personálu v laboratoři (a ostatních zaměstnanců mimo ni) před jakýmkoli rizikem zoonotického onemocnění. Minimální bezpečnostní požadavky na laboratoře v rámci Společenství jsou stanoveny v několika směrnicích. Kromě toho jsou v příslušných evropských normách (EN) vymezeny aspekty týkající se provozu. Provozu diagnosticky zaměřených laboratoří se týkají dodatečné předpisy (EN), jako je správná laboratorní praxe. |
2. Směrnice Společenství týkající se laboratoří
Směrnice Rady 89/391/EHS ze dne 12. června 1989 o zavádění opatření pro zlepšení bezpečnosti a ochrany zdraví zaměstnanců při práci (Úř. věst. L 183, 29.6.1989, s. 1).
Směrnice Rady 90/679/EHS ze dne 26. listopadu 1990 o ochraně pracovníků před riziky spojenými s expozicí biologickým činitelům při práci (sedmá samostatná směrnice ve smyslu čl. 16 odst. 1 směrnice 89/391/EHS) (Úř. věst. L 374, 31.12. 1990, s. 1).
V případě, že se jedná o diagnostický postup pomocí polymerázové řetězové reakce (PCR) a klonování PCR produktů do bakteriálního plasmidu pro propagaci, například pro účely sekvencování DNA, uplatňují se kromě těchto dvou směrnic následující směrnice a evropské normy (EN):
Směrnice Rady 90/219/EHS ze dne 23. dubna 1990 o uzavřeném nakládání s geneticky modifikovanými mikroorganismy (Úř. věst. L 117, 8.5.1990, s. 1).
|
3. |
Vedle směrnic Společenství se musí uznat tyto evropské normy (EN):
Pro provoz/řízení laboratoře platí tyto podmínky: |
4. Požadavky na laboratoře (stupeň zabezpečení 1 až 4)
V souladu se směrnicí Evropského parlamentu a Rady 2000/54/ES ze dne 18. září 2000 o ochraně zaměstnanců před riziky spojenými s expozicí biologickým činitelům při práci (sedmá samostatná směrnice ve smyslu čl. 16 odst. 1 směrnice 89/391/EHS) (Úř. věst. L 262, 17.10.2000, s. 21), směrnicí 90/219/EHS a s evropskými normami: EN 12128, EN 12740, EN 12741.
|
Bezpečnostní opatření |
Stupeň zabezpečení |
|||
|
1 |
2 |
3 |
4 |
|
|
Laboratorní sestava: izolace |
ne |
ano |
ano |
ano |
|
Laboratoře oddělené dveřmi |
ne |
ano |
ano |
ano |
|
Musí být zajištěno pozorovací okno nebo jeho obdoba, aby na přítomné bylo vidět |
volitelné |
volitelné |
volitelné |
ano |
|
Personál musí mít možnost mýt si ruce |
ano |
ano |
ano |
ano |
|
Musí být zajištěna možnost dezinfekce (ruce) |
volitelná |
ano |
ano |
ano |
|
Omezený přístup |
ne |
ano |
ano |
ano |
|
Specifická opatření ke kontrole aerosolu |
ne |
ano minimalizace |
ano prevence |
ano prevence |
|
Označení biologického nebezpečí na dveřích |
ne |
ano |
ano |
ano |
|
Sprchy |
ne |
ne |
volitelné |
ano |
|
Výplach očí |
ano |
ano |
ano |
ano |
|
Laboratoř: zapečetitelná pro zaplynování (fumigaci) |
ne |
ne |
ano |
ano |
|
Povrchy odolné na vodu, kyseliny, alkálie, rozpouštědla, dekontaminační činidla a snadno čistitelné |
ano (stoly) |
ano (stoly) |
ano (stoly, podlaha) |
ano (stoly, podlaha) |
|
Vstup do laboratoře vzduchovým uzávěrem |
ne |
ne |
volitelný |
ano |
|
Negativní tlak v porovnání s tlakem bezprostředního okolí |
ne |
ne |
volitelný |
ano |
|
Extrahovaný a vstupní vzduch z laboratoře se musí filtrovat filtrem s vysokou účinností při odstraňování prachových částic (HEPA) |
ne |
ne |
ano (extrahovaný vzduch) |
ano |
|
Autokláv |
na místě |
v budově |
en suite |
V laboratoři, dvojí zakončení |
|
Ochranný oděv |
Vhodný ochranný oděv |
Vhodný ochranný oděv |
Vhodný ochranný oděv (volitelná obuv) |
Výměna celého oděvu |
|
Rukavice |
ne |
volitelné |
ano |
ano |
|
Účinné tlumení vektoru (například pro hlodavce a hmyz) |
volitelné |
ano |
ano |
ano |
|
Bezpečné uskladnění biologického činidla |
ano |
ano |
ano |
ano |
|
Laboratoř má izolovat své vlastní vybavení |
ne |
ne |
doporučeno |
ano |
Existují dodatečné evropské normy, zaměřené na řízení a organizaci laboratoří.
Existují další národní a mezinárodní předpisy, které se musí dodržovat. Světová zdravotnická organizace (WHO) zveřejnila třetí vydání své Příručky laboratorní biologické bezpečnosti na své internetové stránce:
http://www.who.int/csr/resources/publications/biosafety/WHO_CDS_CSR_LYO_2004_11/en/.
5. Zabezpečení v souvislosti se zdravím zvířat
Veterinární orgány v členských státech musí uplatnit předpisy týkající se zabezpečení virů influenzy ptáků, zejména HPAI, avšak rovněž i veškerých virů influenzy ptáků podtypů H5 a H7. Určité pokyny uvádí Světová organizace pro zdraví zvířat (OIE) v kapitole 1.4.5 Kodexu zdraví suchozemských živočichů z roku 2005 a OIE považuje HPNAI za patogen ze skupiny 4, kam se řadí patogeny, které se musí zabezpečit.
Předpisy upravující nakládání s viry influenzy ptáků zavedou do praxe veterinární orgány členského státu.
Minimální bezpečnostní požadavky uplatňované referenční laboratoří Společenství, které jsou národními pravidly Spojeného království, jsou dostupné na této internetové stránce:
http://www.defra.gov.uk/corporate/vla/science/science-viral-ai-reflab.htm.
6. Zabezpečení v souvislosti s lidským zdravím
Laboratoře zacházející s viry influenzy ptáků si musí být vždy vědomy toho, že se jedná přinejmenším o potenciální lidské patogeny, a zajišťovat provoz tak, aby se zabránilo nákaze pracovníků laboratoře a jakémukoli úniku viru a nákaze lidí mimo laboratoř.
Pokyny o nakládání se vzorky podezřelými z přítomnosti viru influenzy ptáků typu A jsou dostupné na internetové stránce Světové zdravotnické organizace (WHO):
http://www.who.int/csr/disease/avian_influenza/guidelines/handlingspecimens/en/.
(1) Pro tyto účely by se měly vzorky v plném rozsahu odebrat a uskladnit k pozdějšímu vyhodnocení.