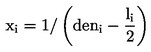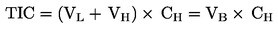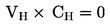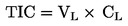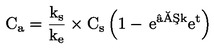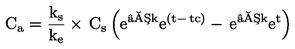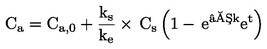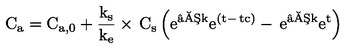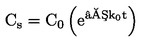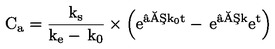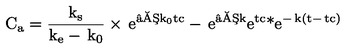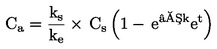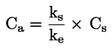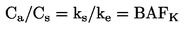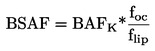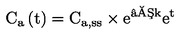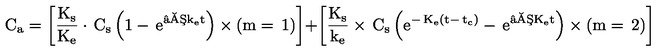|
10)
|
Doplňují se kapitoly C.27, C.28, C.29 a C.30, které znějí:
„C.27 TEST TOXICITY NA CHIRONOMIDAE V SYSTÉMU SEDIMENT-VODA ZA POUŽITÍ OBOHACENÉHO SEDIMENTU
ÚVOD
|
1.
|
Tato zkušební metoda odpovídá pokynu OECD pro zkoušení (TG) 218 (2004). Tato zkušební metoda je určena k posouzení účinků dlouhodobé expozice larev sladkovodních pakomárů Chironomus sp. žijících v sedimentu chemickým látkám. Je založena na stávajících protokolech o zkoušce toxicity pro Chironomus riparius a Chironomus tentans, která byla vyvinuta v Evropě (1, 2, 3) a v Severní Americe (4, 5, 6, 7, 8) a ověřována v mezilaboratorních porovnávacích zkouškách (1, 6, 9). Lze užít rovněž další dobře zdokumentované druhy pakomárů, jako například Chironomus yoshimatsui (10, 11).
|
|
2.
|
Scénář expozice užitý při této zkušební metodě je vmíchání zkoušené látky do sedimentu. Výběr vhodného scénáře expozice závisí na zamýšleném použití testu. Účelem scénáře vmíchání látky do sedimentu je simulovat nahromaděné množství chemických látek přetrvávajících v sedimentu. Tento systém expozice zahrnuje vmíchání látky do sedimentu ve zkušebním systému sediment–voda.
|
|
3.
|
Látky, které je třeba testovat z hlediska organismů žijících v sedimentu, v této složce obvykle přetrvávají po dlouhá časová období. Expozici organismů žijících v sedimentu lze zajistit celou řadou možných cest. Relativní význam jednotlivých cest, jimiž dochází k expozici, a doba nezbytná k tomu, aby každá z nich přispěla k celkovým toxickým účinkům, jsou závislé na fyzikálně chemických vlastnostech dotčené chemické látky. V případě silně adsorbujících látek (např. log Kow > 5) nebo pro chemické látky s kovalentní vazbou na sediment může být významnou expoziční cestou požití kontaminované potravy. Aby nedošlo k podcenění toxicity vysoce lipofilních látek, lze zvážit užití potravy přidané do sedimentu před aplikací zkoušené chemické látky. Aby bylo možné zohlednit všechny potenciální způsoby expozice, zaměřuje se tato zkušební metoda na dlouhodobou expozici. Délka trvání zkoušky se pohybuje v rozmezí 20–28 dní pro C. riparius and C. yoshimatsui a 28–65 dní pro C. tentans. Pokud jsou pro konkrétní účel, například pro studium účinků nestabilní chemické látky, potřebné krátkodobé údaje, mohou být další duplikátní vzorky po deseti dnech odstraněny.
|
|
4.
|
Měřené výsledné účinky se rovnají celkovému počtu vylíhlých dospělců a času do vylíhnutí. Pokud jsou nezbytné další krátkodobé údaje, doporučuje se provádět měření přežití a růstu larev až po uplynutí desetidenního období, podle potřeby s využitím dalších duplikátních vzorků.
|
|
5.
|
Doporučuje se použití sedimentu doplněného přísadami. Přísadami doplněný sediment má několik výhod oproti přírodním sedimentům:
|
—
|
jeho experimentální variabilita je snížena, protože tvoří reprodukovatelnou „standardizovanou matrici“ a je eliminována potřeba hledat zdroje nekontaminovaného čistého sedimentu,
|
|
—
|
zkoušky lze zahájit kdykoliv, aniž by bylo nutno čelit sezonním výkyvům zkušebního sedimentu, a sediment není třeba předem upravit, aby se z něj odstranili původní živočichové; užití přísadami doplněného sedimentu také snižuje náklady spojené s terénním shromažďováním dostatečného množství sedimentu pro rutinní testování,
|
|
—
|
užití přísadami doplněného sedimentu umožňuje porovnání toxicity a odpovídající řazení látek.
|
|
|
6.
|
Použité definice jsou uvedeny v dodatku 1.
|
PODSTATA ZKOUŠKY
|
7.
|
Larvy pakomárů v prvním instaru jsou vystaveny koncentračnímu rozmezí zkoušené chemické látky v systému sediment–voda. Zkoušená látka se vmíchá do sedimentu a následně jsou do zkušebních kádinek se stabilizovanou koncentrací sedimentu a vody nasazeny larvy prvního instaru. Na konci zkoušky se měří rychlost líhnutí a vývoje pakomárů. V případě potřeby lze po 10 dnech měřit rovněž přežití larev a jejich hmotnost (v případě potřeby lze použít další duplikátní vzorky). Tyto údaje se analyzují buď pomocí regresního modelu s cílem odhadnout koncentraci, která by způsobila x% snížení líhnutí nebo přežití či růstu larev (např. EC15, EC50, atd.), nebo s využitím testování statistických hypotéz pro stanovení NOEC/LOEC. Posledně uvedená metoda vyžaduje srovnání hodnoty účinku s kontrolními hodnotami pomocí statistických testů.
|
INFORMACE O ZKOUŠENÉ LÁTCE
|
8.
|
Měla by být známa rozpustnost zkoušené chemické látky ve vodě, její tlak par, naměřená nebo vypočtená distribuce v sedimentu a stabilita ve vodě a sedimentu. Měla by být k dispozici spolehlivá analytická metoda pro kvantitativní stanovení zkoušené chemické látky ve vodě nad sedimentem, kapilární vodě a v sedimentu, a to se známou a doloženou přesností a mezí stanovitelnosti. Užitečné informace zahrnují strukturní vzorec a čistotu zkoušené chemické látky. Užitečnou informací je rovněž chemický osud zkoušené chemické látky (např. zánik, abiotický a biotický rozklad atd.). Další návod pro zkoušení látek s fyzikálně chemickými vlastnostmi, které činí jejich zkoušení obtížné, je uveden v položce seznamu literatury (12).
|
REFERENČNÍ CHEMICKÉ LÁTKY
|
9.
|
Referenční chemické látky mohou být pravidelně kontrolovány pro ověření, že zkušební podmínky a protokol o zkoušce jsou spolehlivé. Příkladem referenčních toxických látek úspěšně použitých v mezilaboratorních zkouškách a validačních studiích jsou lindan, trifluralin, pentachlorfenol, chlorid kademnatý a chlorid draselný (1, 2, 5, 6, 13).
|
PLATNOST ZKOUŠKY
|
10.
|
Aby byla zkouška platná, měly by být splněny tyto podmínky:
|
—
|
vylíhnutí v kontrolních nádobách musí být na konci zkoušky nejméně 70 % (1, 6),
|
|
—
|
k líhnutí dospělců C. riparius a C. yoshimatsui v kontrolních nádobách by mělo dojít mezi 12. a 23. dnem po jejich zavedení do nádob; pro C. tentans je nutná doba 20–65 dnů,
|
|
—
|
na konci zkoušky se v každé nádobě změří pH a koncentrace rozpuštěného kyslíku. Koncentrace kyslíku by měla činit alespoň 60 procent hodnoty nasycení vzduchem (ASV) při použité teplotě a pH vody nad sedimentem by se mělo ve všech zkušebních nádobách pohybovat v rozmezí pH 6–9,
|
|
—
|
teplota vody by se neměla lišit o více než ± 1,0 °C. Teplota vody může být řízena v izotermální místnosti a v tomto případě by měla být teplota v místnosti ve vhodném časovém intervalu potvrzována.
|
|
POPIS METODY
Zkušební nádoby
|
11.
|
Studie se provádí ve skleněných 600ml kádinkách o průměru 8 cm. Vhodné jsou i jiné nádoby, ale měly by zaručit odpovídající hloubku vody nad sedimentem a sedimentu. Plocha sedimentu by měla být dostatečná, aby poskytovala 2 až 3 cm2 na larvu. Poměr hloubky sedimentu k hloubce vody nad sedimentem by měl být 1:4. Zkušební nádoby a další aparatura, která přichází do styku se zkušebním systémem, by měly být celé zhotoveny ze skla nebo z jiného chemicky inertního materiálu (např. z teflonu).
|
Výběr druhů
|
12.
|
Při zkoušce má být přednostně užito druhu Chironomus riparius. Vhodný je i druh Chironomus tentans, avšak hůře se s ním manipuluje a vyžaduje i delší trvání zkoušky. Lze užít rovněž druh Chironomus yohimatsui. Podrobnosti o kultivačních metodách pro druh Chironomus riparius jsou uvedeny v dodatku 2. Informace o kultivačních podmínkách jsou k dispozici také pro jiné druhy, tj. Chironomus tentans (4) a Chironomus yoshimatsui (11). Identifikace druhu musí být potvrzena před zkouškou, ale není vyžadována před každou zkouškou, pokud organismy pocházejí z domácí kultury.
|
Sediment
|
13.
|
Při zkoušce se doporučuje přednostně užívat přísadami doplněný sediment (nazývaný rovněž rekonstituovaný, artificiální nebo syntetický sediment). Pokud se však použije přírodní sediment, je potřeba ho charakterizovat (alespoň pH, obsah organického uhlíku a doporučuje se i stanovení dalších parametrů, jako je poměr C/N a zrnitost), a měl by být prost veškerého znečištění a dalších organismů, které by mohly pakomárům konkurovat nebo je konzumovat. Doporučuje se také přírodní sediment před použitím při zkoušce toxicity pro pakomáry kondicionovat po dobu sedmi dnů za stejných podmínek, které převládají v následující zkoušce. Pro použití v této zkoušce se doporučuje následující přísadami doplněný sediment založený na umělé půdě užité při zkušební metodě C.8 (14) (1, 15, 16):
|
a)
|
4–5 % (sušiny) rašeliny s pH co nejblíže 5,5 až 6,0; je důležité, aby byla ve formě prášku, jemně namletá (velikost částic ≤ 1 mm) a sušená výhradně na vzduchu;
|
|
b)
|
20 % (sušiny) kaolinitického jílu (pokud možno s více než 30 % kaolinitu);
|
|
c)
|
75–76 % (sušiny) křemenného písku (měl by převažovat jemný písek s více než 50 % částic velikosti 50 až 200 μm);
|
|
d)
|
přidá se deionizovaná voda s cílem dosáhnout 30–50 % vlhkosti v konečné směsi;
|
|
e)
|
přidá se chemicky čistý uhličitan vápenatý (CaCO3) pro úpravu pH konečné směsi sedimentu na pH 7,0 ± 0,5. Obsah organického uhlíku v konečné směsi by měl být 2 % (± 0,5 %) a je třeba jej upravit použitím vhodného množství rašeliny a písku v souladu s písm. a) a c).
|
|
|
14.
|
Rašelina, kaolinitický jíl a písek by měly pocházet ze známého zdroje. Jednotlivé složky sedimentu by měly být kontrolovány z hlediska nepřítomnosti chemické kontaminace (např. těžké kovy, chlorované organické sloučeniny, organofosforové sloučeniny atd.). Příklad přípravy přísadami doplněného sedimentu je popsán v dodatku 3. Přijatelné je i míchání suchých složek, pokud se prokáže, že po přidání vody nad sedimentem nedochází k separaci složek sedimentu (např. plovoucí částice rašeliny) a že rašelina nebo sediment jsou dostatečně kondicionovány.
|
Voda
|
15.
|
Pro tuto zkoušku je vhodná jakákoli voda, která vyhovuje chemickým charakteristikám přípustné ředicí vody uvedeným v dodatcích 2 a 4. Jakákoli vhodná voda, přírodní voda (povrchová nebo podzemní), rekonstituovaná voda (viz příloha 2) nebo odchlorovaná vodovodní voda je přijatelná jako kultivační a zkušební voda, pokud v ní pakomáři přežijí po dobu kultivace a zkoušení bez známek stresu. Na začátku zkoušky by se hodnota pH zkušební vody měla pohybovat mezi 6 a 9 a její celková tvrdost by neměla být vyšší než 400 mg/l CaCO3. V případě, že je podezření na interakci mezi ionty způsobujícími tvrdost vody a zkoušenou látkou, měla by však být použita voda nižší tvrdosti (a proto v této situaci nelze použít Elendtovo médium M4). V průběhu celé studie by měl být užíván stejný typ vody. Charakteristiky jakosti vody uvedené v dodatku 4 by měly být měřeny nejméně dvakrát ročně, nebo pokud existuje podezření, že mohlo dojít k podstatné změně těchto vlastností.
|
Zásobní roztoky – obohacené sedimenty
|
16.
|
Obohacené sedimenty zvolené koncentrace se obvykle připraví přidáním roztoku zkoušené chemické látky přímo do sedimentu. Zásobní roztok zkoušené chemické látky rozpuštěné v deionizované vodě se smísí s přísadami doplněným sedimentem pomocí krouživé míchačky, míchačky krmiv nebo ručním smícháním. Je-li zkoušená látka špatně rozpustná ve vodě, může být rozpuštěna v co nejmenším objemu vhodného organického rozpouštědla (např. hexanu, acetonu nebo chloroformu). Tento roztok se pak smísí s 10 g jemného křemičitého písku na jednu zkušební nádobu. Rozpouštědlo se nechá odpařit a musí být zcela odstraněno z písku, písek se pak smísí s vhodným množstvím usazenin na jednotlivé zkušební kádinky. K rozpuštění, dispergaci nebo emulgaci zkoušené chemické látky mohou být použita pouze činidla, která snadno vytěkají. Je třeba mít na paměti, že při přípravě sedimentu je nutno zohlednit písek ze zkoušené chemické látky a směsi písku (tj. při přípravě sedimentu by proto mělo být použito menší množství písku). Je třeba dbát, aby zkoušená látka přidaná do sedimentu byla v sedimentu důkladně a rovnoměrně rozložena. Pokud je to nutné, lze analyzovat dílčí vzorky za účelem stanovení stupně homogenity.
|
USPOŘÁDÁNÍ ZKOUŠKY
|
17.
|
Uspořádáním zkoušky se rozumí výběr počtu zkušebních koncentrací a jejich odstupňování, počet nádrží pro každou koncentraci a počet larev v nádrži. Jsou popsána uspořádání pro odhad koncentrace vyvolávající účinek EC, pro odhad NOEC a pro provedení limitní zkoušky.
|
Uspořádání pro regresní analýzu
|
18.
|
Koncentrace použité ve zkoušce musí v každém případě pokrývat koncentraci vyvolávající účinek (např. EC15, EC50) a rozsah koncentrací, při nichž dochází k účinku, který je předmětem zájmu. Obecně platí, že přesnost, a zejména platnost, s níž lze provést odhady koncentrace vyvolávající účinek (ECx), se zvýší, pokud se daná koncentrace vyvolávající účinek nachází v rozmezí zkoušených koncentrací. Je třeba se vyhnout extrapolaci hluboko pod nejnižší pozitivní koncentrací nebo přesahující nejvyšší koncentraci. Předběžná orientační zkouška je užitečná pro výběr rozsahu koncentrací, které mají být použity (viz odstavec 27).
|
|
19.
|
V případě, že ECx je třeba odhadnout, je třeba zkoušku provést alespoň v pěti koncentracích a třech opakováních pro každou koncentraci. V každém případě je vhodné, aby byly užity dostatečné zkušební koncentrace umožňující dobrý odhad modelu. Faktor mezi koncentracemi nesmí být větší než 2 (výjimku lze učinit v případech, kdy má křivka závislosti odezvy na dávce malý sklon). Počet opakování při každé expozici lze snížit, pokud se zvýší počet zkušebních koncentrací s různými odezvami. Zvýšení počtu opakování nebo snížení velikosti zkušebních koncentrací obvykle vede k zúžení intervalu spolehlivosti zkoušky. Pro odhad desetidenního přežití a růstu larev jsou nutná další opakování.
|
Uspořádání odhadu NOEC/LOEC
|
20.
|
Pro odhad LOEC nebo NOEC se použije pět zkušebních koncentrací s nejméně čtyřmi opakováními a faktor mezi koncentracemi by neměl být vyšší než 2. Počet opakování by měl být dostatečný, aby zajistil odpovídající statistickou významnost, s jakou má být rozeznán 20 % rozdíl oproti kontrolnímu vzorku na 5 % hladině významnosti (p = 0,05). Pro rychlost vývoje je zpravidla vhodné použít analýzu rozptylu (ANOVA) jako například Dunnettův nebo Williamsův test (17, 18, 19, 20). Pro procento vylíhlých jedinců lze použít Cochranův-Armitageův test, Fisherův exaktní test (s Bonferroniho korekcí) nebo Mantelův-Haenszelův test.
|
Limitní zkouška
|
21.
|
Limitní zkouška může být provedena (jedna zkušební koncentrace a kontrola), pokud nebyl zjištěn žádný dopad při předběžné orientační zkoušce. Účelem limitní zkoušky je provést zkoušku při dostatečně vysoké koncentraci umožňující osobám s rozhodovací pravomocí vyloučit možné toxické účinky zkoušené chemické látky a limit je stanoven v takové koncentraci, jejíž výskyt se v žádném případě nepředpokládá. Doporučená koncentrace je 1 000 mg/kg (sušiny). Obvykle je pro expozici i kontrolu zapotřebí alespoň šesti opakování. Počet opakování by měl být dostatečný, aby zajistil odpovídající statistickou významnost, s jakou má být rozeznán 20 % rozdíl oproti kontrolnímu vzorku na 5 % hladině významnosti (p = 0,05). S metrickou reakcí (rychlost vývoje a hmotnost), je t-test vhodnou statistickou metodou, pokud údaje splňují požadavky tohoto testu (normalita, homogenní rozptyly). Pokud tyto požadavky splněny nejsou, lze použít t-test nestejných rozptylů nebo neparametrický test, jako je například Wilcoxon-Mann-Whitneyův test. Pro procento vylíhlých jedinců je vhodný Fisherův exaktní test.
|
POSTUP
Podmínky expozice
Příprava systému obohacený sediment–voda
|
22.
|
Pro aplikaci zkoušené chemické látky se doporučuje postup vmíchání popsaný ve zkušební metodě C.8: Toxicita pro žížaly (14). Obohacené sedimenty se umístí do nádob a přidá se voda nad sediment tak, aby vznikl objemový poměr vody a sedimentu 1:4 (viz odstavce 11 a 15). Hloubka vrstvy sedimentu by se měla pohybovat v rozmezí od 1,5 do 3 cm. Aby se zabránilo oddělení složek sedimentu a resuspenzi jemného materiálu v průběhu přidávání zkušební vody ve vodním sloupci, lze sediment přikrýt plastovým diskem, na který se voda nalije, a disk se bezprostředně poté vyjme. Mohou být vhodná i jiná zařízení.
|
|
23.
|
Zkušební nádoby se přikryjí (například skleněnými víčky). Pokud je to nutné, v průběhu studie se hladina vody doplní na původní objem s cílem kompenzovat odpařování vody. K tomuto účelu by měla být použita destilovaná nebo deionizovaná voda, aby se zabránilo hromadění solí.
|
Stabilizace
|
24.
|
Jakmile je připraven obohacený sediment s vodou nad sedimentem, je žádoucí umožnit rozdělení zkoušené chemické látky z vodné fáze do sedimentu (3, 4, 6, 13). To by se mělo provádět pokud možno za stejných podmínek z hlediska teploty a provzdušňování, které byly použity při zkoušce. Vhodná rovnovážná doba je specifická pro konkrétní sediment a chemickou látku a může se pohybovat v řádu hodin až dní, zřídka až několika týdnů (4–5 týdnů). Vzhledem k tomu, že tato doba by umožnila rozklad mnoha chemických látek, není očekávána rovnováha, ale doporučuje se doba do ustavení rovnováhy v trvání 48 hodin. Na konci této další doby do ustavení rovnováhy by měla být změřena koncentrace zkoušené chemické látky ve vodě nad sedimentem, v kapilární vodě a v sedimentu, a to nejméně při nejvyšší koncentraci a při jedné nižší koncentraci (viz odstavec 38). Tato analytická stanovení zkoušené chemické látky umožňují výpočet hmotnostní bilance a vyjádření výsledků na základě naměřených koncentrací.
|
Přidání zkušebních organismů
|
25.
|
Čtyři až pět dnů před přidáním zkušebních organismů do zkušebních nádob by měly být z kultur odebrány shluky vajíček a umístěny do malých nádob do kultivačního média. Lze použít starší médium ze zásobní kultury nebo čerstvě připravené médium. Pokud je použito čerstvé médium, mělo by být do kultivačního média přidáno malé množství potravy, např. zelené řasy a/nebo několik kapek filtrátu z jemně mleté suspenze vločkového krmiva pro ryby (viz dodatek 2). Měly by být použity pouze čerstvě nakladené shluky vajíček. Za normálních okolností se larvy začínají líhnout několik dní po nakladení vajíček (2 až 3 dny u Chironomus riparius při 20 °C a 1 až 4 dny u Chironomus tentans při 23 °C a Chironomus yoshimatui při 25 °C) a během larválního vývoje se vystřídají čtyři instary, z nichž každý trvá 4–8 dnů. Při zkoušce se použijí larvy prvního instarového stadia (2–3 nebo 1–4 dnů po vylíhnutí). Instar pakomárů lze případně zkontrolovat pomocí šířky hlavové kapsuly (6).
|
|
26.
|
Dvacet larev prvního instaru se pomocí pipety bez špičky náhodně rozdělí do jednotlivých zkušebních nádob obsahujících obohacený sediment a vodu. Provzdušňování vody je nutné ukončit při přidání larev do zkušebních nádob a znovu ho zahájit nejdříve po uplynutí dalších 24 hodin po přidání larev (viz odstavce 25 a 32). Podle použitého uspořádání zkoušky (viz odstavce 19 a 20) je počet larev užitý na jednu koncentraci minimálně 60 pro odhad koncentrace vyvolávající účinek a 80 pro stanovení NOEC.
|
Zkušební koncentrace
|
27.
|
Orientační zkouška může být užitečná pro stanovení rozsahu koncentrací pro vlastní zkoušku. K tomuto účelu jsou pakomáři exponováni řadě široce odstupňovaných koncentrací zkoušené chemické látky. S cílem zajistit stejnou hustotu povrchu na jednoho pakomára, která má být užita pro vlastní zkoušku, se pakomáři vystaví jednotlivým koncentracím zkoušené chemické látky po dobu, která umožňuje odhad vhodných zkušebních koncentrací; opakování nejsou vyžadována.
|
|
28.
|
Zkušební koncentrace pro vlastní zkoušku jsou stanoveny podle výsledku zjištění předběžné orientační zkoušky. Mělo by být vybráno a použito nejméně pět koncentrací v souladu s popisem uvedeným v odstavcích 18 až 20.
|
Kontroly
|
29.
|
Při zkoušce se použijí kontrolní nádoby bez zkoušené chemické látky, avšak obsahující sediment, s příslušným počtem opakování (viz odstavce 19–20). Pokud bylo pro aplikaci zkoušené chemické látky použito rozpouštědlo (viz odstavec 16), bude přidána kontrola rozpouštědla v sedimentu.
|
Zkušební zařízení
|
30.
|
Užívají se statické systémy. Ve výjimečných případech, jako například tehdy, pokud je specifikace kvality vody nevhodná pro růst zkušebního organismu nebo ovlivňuje chemickou rovnováhu (např. přílišný pokles úrovně rozpuštěného kyslíku, přílišné zvýšení koncentrace exkrementů nebo výluh minerálů ze sedimentů, který ovlivňuje pH a/nebo tvrdost vody) lze použít semistatické nebo průtokové systémy s přerušovanou nebo kontinuální obnovou vody nad sedimentem. Zpravidla však budou postačující a vhodnější jiné metody zvýšení jakosti vody nad sedimentem, jako je například provzdušňování.
|
Krmení
|
31.
|
Larvy je třeba krmit optimálně denně nebo nejméně třikrát týdně. Jako dostatečná dávka pro mladé larvy po dobu prvních 10 dnů se jeví krmivo pro ryby (suspenze ve vodě nebo jemně rozmělněné krmivo, např. Tetra-Min nebo Tetra-Phyll, viz podrobnosti v dodatku 2) v množství 0,25 až 0,5 mg (0,35 až 0,5 mg pro C. yoshimatui) na larvu za den. Starší larvy mohou potřebovat o něco větší množství potravy: po zbývající dobu zkoušky by mělo dostačovat 0,5–1 mg na larvu denně. U všech expozic by se měl snížit přísun potravy a mělo by se kontrolovat, zda dochází k růstu plísní nebo je pozorována mortalita. Pokud není možné růst plísní zastavit, je nutno zkoušku opakovat. Při testování silně adsorbujících látek (např. log Kow > 5) nebo látek s kovalentní vazbou na sediment lze dávku potravy nezbytnou pro zajištění přežití a přirozeného růstu organismů přidat do přísadami doplněného sedimentu před fází stabilizace. V takovém případě je nutno místo krmiva pro ryby použít rostlinný materiál, například přídavek 0,5 % (sušiny) jemně mletých listů např. kopřivy dvoudomé (Urtica dioica), morušovníku bílého (Morus alba), jetele plazivého (Trifolium repens), špenátu setého (Spinacia oleracea) nebo jiného rostlinného materiálu (Cerophylu nebo alfa-celulózy).
|
Inkubační podmínky
|
32.
|
Voda nad sedimentem ve zkušebních nádobách se mírně provzdušňuje v optimálním případě 24 hodin po přidání larev a je sledována po celou dobu zkoušky (je třeba dbát, aby koncentrace rozpuštěného kyslíku neklesla pod 60 procent ASV). Provzdušňování se provádí pomocí skleněné Pasteurovy pipety upevněné 2–3 cm nad vrstvou sedimentu (tj. jedna nebo několik bublin/s). Při zkoušení těkavých chemických látek lze zvolit možnost systém sediment-voda neprovzdušňovat.
|
|
33.
|
Zkouška se provádí při konstantní teplotě 20 °C (± 2 °C). Doporučená teplota pro C. tentans je 23 °C a pro C. yoshimatui 25 °C (± 2 °C). Fotoperioda je 16 hodin a intenzita světla by měla být 500 až 1 000 lux.
|
Trvání expozice
|
34.
|
Expozice je zahájena přidáním larev do obohacených a kontrolních nádob. Maximální délka trvání expozice je 28 dnů pro C. riparius a C. yoshimatsui a 65 dnů pro C. tentans. Pokud se pakomáři vylíhnou dříve, lze zkoušku ukončit po uplynutí nejméně pěti dnů od vylíhnutí posledního dospělce v kontrolní nádobě.
|
Pozorování
Líhnutí
|
35.
|
Určí se čas potřebný pro vývoj a celkový počet plně vylíhlých samců a samic pakomárů. Samce lze snadno rozlišit podle vějířovitých tykadel.
|
|
36.
|
Zkušební nádoby se kontrolují alespoň třikrát týdně s cílem vizuálně posoudit jakékoli neobvyklé chování (např. opouštění sedimentu, neobvyklé plavání) ve srovnání s kontrolními nádobami. Během období předpokládaného líhnutí je nutné denně počítat vylíhlé pakomáry. Pohlaví a počet plně vylíhlých pakomárů se denně zaznamenávají. Po identifikaci se pakomáři z nádob odstraní. Veškeré shluky vajíček nakladené před ukončením testu se zaznamenají a pak se odstraní, aby se zabránilo opětovnému zavlečení larev do sedimentu. Zaznamená se rovněž počet viditelných kukel, které se dosud nevylíhly. Pokyny pro měření líhnutí jsou uvedeny v dodatku 5.
|
Růst a přežívání
|
37.
|
Pokud je nutné uvést údaje o desetidenním přežití a růstu larev, je třeba na počátku zkoušky přidat další zkušební nádoby tak, aby je bylo možné následně použít. Sediment z těchto dalších nádob se proseje za použití síta o velikosti 250 μm, které udrží larvy. Kritéria uhynutí jsou nepohyblivost nebo nedostatečná reakce na mechanické podněty. Larvy, které nejsou nalezeny, by měly být rovněž považovány za uhynulé (larvy uhynulé na počátku zkoušky mohly být již rozloženy mikroby). Stanoví se hmotnost sušiny (prosté popelovin) larev, které přežily, na zkušební nádobu a vypočte se průměrná individuální hmotnost sušiny na nádobu. Je vhodné určit, do kterého instaru přežívající larvy patří, pomocí změření šířky hlavové kapsuly každého jedince.
|
Analytická měření
Koncentrace zkoušené chemické látky
|
38.
|
Před zahájením zkoušky (tj. přidáním larev), se alespoň z jedné nádoby na každou expozici odstraní souhrnné vzorky sedimentu za účelem analytického stanovení koncentrace zkoušené chemické látky v sedimentu. Doporučuje se, aby byly analyzovány minimálně vzorky vody nad sedimentem, kapilární vody a sedimentu na počátku (viz bod 24) a na konci zkoušky při nejvyšší koncentraci a jedné nižší koncentraci. Tato stanovení koncentrace zkoušené chemické látky poskytují informace o chování/distribuci zkoušené chemické látky v systému voda–sediment.
|
|
39.
|
Při provádění průběžných měření (např. 7. den) a v případě, že jsou pro analýzu zapotřebí rozsáhlé vzorky, které nelze ze zkušebních nádob odebrat bez dopadu na zkušební systém, je potřeba provést analytická stanovení na vzorcích z dalších zkušebních nádob, s nimiž bylo zacházeno stejným způsobem (včetně přítomnosti zkušebních organismů), ale nebyly použity pro biologická pozorování.
|
|
40.
|
Doporučeným postupem izolace intersticiální vody je odstřeďování např. při 10 000 g a 4 °C po dobu 30 minut. Neadsorbuje-li se však zkoušená látka prokazatelně na filtry, je přijatelná i filtrace. V některých případech může být nemožné provést analýzu koncentrací v kapilární vodě vzhledem k tomu, že vzorek je příliš malý.
|
Fyzikálně-chemické parametry
|
41.
|
pH a teplotu ve zkušebních nádobách je nutno měřit vhodným způsobem (viz odstavec 10). Tvrdost a obsah amoniaku by měly být měřeny v kontrolních nádobách a v jedné zkušební nádobě při nejvyšší koncentraci na počátku zkoušky a na jejím konci.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Zpracování výsledků
|
42.
|
Účelem této zkoušky je stanovit účinek zkoušené chemické látky na rychlost vývoje a celkový počet plně vylíhlých samců a samic, pakomárů nebo v případě desetidenní zkoušky účinky na přežití a hmotnost larev. Pokud nejsou k dispozici žádné údaje o statistických rozdílech citlivosti mezi oběma pohlavími, lze výsledky pro samce a pro samice sloučit pro účely statistické analýzy. Rozdíly v citlivosti mezi pohlavími lze statisticky posoudit např. pomocí tabulkového χ2 – r × 2 testu. Je-li vyžadováno stanovení přežití larev a průměru individuální sušiny na jednu nádobu, je nutno tak učinit po 10 dnech.
|
|
43.
|
Koncentrace s pozorovanými účinky vyjádřené a vztažené k sušině se vypočtou přednostně na základě naměřených koncentrací sedimentu na počátku zkoušky (viz odstavec 38).
|
|
44.
|
Pro výpočet bodového odhadu EC50 nebo jakékoli jiné hodnoty ECx lze jako skutečné opakování použít statistiku na jednu nádobu. Při výpočtu intervalu spolehlivosti pro každý ECx je nutno zohlednit variabilitu mezi jednotlivými nádobami, případně prokázat, že tato variabilita je tak nízká, že ji lze ignorovat. Je-li u modelu užita metoda nejmenších čtverců, je nutné u statistik jednotlivých nádob uplatnit transformaci za účelem homogenity rozptylu. Hodnoty ECx je však třeba vypočítat až poté, co je reakce převedena zpět na původní hodnotu.
|
|
45.
|
Pokud je cílem statistické analýzy stanovení hodnoty NOEC/LOEC testováním hypotéz, je nutno vzít v úvahu variabilitu mezi nádobami, například pomocí analýzy rozptylu ANOVA. Případně mohou být vhodnější robustnější testy (21) v případě, že dojde k porušení předpokladů obvykle užitých při analýze ANOVA.
|
Procento vylíhlých jedinců
|
46.
|
Procenta vylíhlých jedinců jsou binární údaje a lze je analyzovat s použitím postupně klesajícího Cochranova-Armitageova testu, který předpokládá monotónní odezvu na dávku, a údaje jsou konzistentní s tímto očekáváním. V opačném případě lze použít Fisherův exaktní test nebo Mantelův-Haenszelův test s Bonferroniho-Holmovou korekcí p-hodnot. Pokud existují důkazy o větší variabilitě mezi replikacemi ve stejné koncentraci, pak by binomické rozdělení (často uváděné jako „extra-binomická“ variabilita) nasvědčovalo tomu, že je nutno použít robustní Cochranův-Armitageův test nebo Fisherův exaktní test, jak je navrhováno v odstavci (21).
Určí se součet pakomárů vylíhlých v jedné nádobě ne a vydělí se počtem vložených larev na:
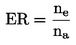
kde:
|
ER
|
=
|
procento vylíhlých jedinců,
|
|
ne
|
=
|
počet pakomárů vylíhlých v nádobě,
|
|
na
|
=
|
počet larev nasazených do nádoby.
|
|
|
47.
|
Nejvhodnější alternativou pro rozsáhlé vzorky s extra binomickou variací je pojmout procento vylíhlých jedinců jako kontinuální odezvu a použít postupy, jako je například Williamsův test, pokud existuje předpoklad monotónní odezvy na dávku a je konzistentní s těmito daty ER. V případě nemonotónní odezvy by byl vhodný Dunnettův test. Rozsáhlý vzorek je zde definován situací, při níž jak počet vylíhlých jedinců, tak počet nevylíhlých jedinců přesáhnou v jednom duplikátním vzorku (nádobě) hodnotu pět.
|
|
48.
|
Při použití metody ANOVA je nutno hodnoty ER nejprve transformovat (například druhou odmocninou funkce arcsin) nebo transformací podle Freemana-Tukeyho s cílem získat přibližné normální rozdělení údajů a vyrovnat odchylky. Při použití absolutních frekvencí lze použít test dle Cochrana-Armitage, Fisherův exaktní test (s Bonferroniho korekcí), nebo Mantelův-Haenszelův test. Transformace funkcí √arcsin se vypočte pomocí převrácené hodnoty sinu (sin–1) z odmocniny ER.
|
|
49.
|
Pro procento vylíhlých jedinců se hodnoty ECx vypočtou pomocí regresní analýzy (nebo např. pomocí modelu probit (22), logit, Weibull, vhodného komerčního softwaru atd.). V případě selhání regresní analýzy (např. v případě méně než dvou koncentrací s parciálními odezvami) se použijí další neparametrické metody, jako je například klouzavý průměr nebo prostá interpolace.
|
Rychlost vývoje
|
50.
|
Průměrná doba vývoje představuje průměrné časové rozpětí mezi nasazením larev (den 0 zkoušky) a vylíhnutím experimentální kohorty pakomárů. (Pro výpočet skutečné doby vývoje by mělo být zohledněno stáří larev v okamžiku nasazení. Rychlost vývoje je převrácenou hodnotou doby vývoje (jednotka: 1/den) a představuje tu část larválního vývoje, která se odehraje za den. Rychlost vývoje je z hlediska hodnocení těchto studií toxicity sedimentů preferována před dobou vývoje vzhledem k její nižší variabilitě, vyšší homogenitě a vyšší blízkosti normálnímu rozdělení. Z tohoto důvodu mohou být použity silné parametrické zkušební postupy pro rychlost vývoje spíše než pro dobu vývoje. Pro rychlost vývoje jako kontinuální odezvu lze hodnoty ECx stanovit odhadem pomocí regresní analýzy (např. (23), (24)).
|
|
51.
|
U následujících statistických testů se má za to, že počet pakomárů pozorovaných v inspekčním dni × se vylíhl v průměru časového intervalu mezi dnem x a dnem x – l (l = délka intervalu mezi pozorováními, obvykle 1 den). Průměrná rychlost vývoje na nádobu (x) se vypočte podle vzorce:
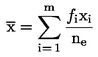
kde:
|
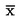
|
:
|
střední rychlost vývoje v kádince,
|
|
i
|
:
|
index intervalu mezi pozorováními,
|
|
m
|
:
|
počet všech intervalů mezi pozorováními,
|
|
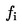
|
:
|
počet vylíhlých jedinců během daného intervalu i mezi pozorováními,
|
|
ne
|
:
|
počet vylíhlých jedinců celkem na konci pokusu 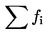 , ,
|
|
x
|
:
|
rychlost vývoje larev vylíhlých v intervalu i,
|
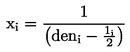
kde:
|
deni
|
:
|
den pozorování (ve dnech od aplikace),
|
|
li
|
:
|
délka intervalu mezi pozorováními (ve dnech, obvykle 1 den).
|
|
Protokol o zkoušce
|
52.
|
Protokol o zkoušce musí obsahovat minimálně tyto údaje:
|
|
Zkoušená látka:
|
—
|
fyzikální povahu a případně fyzikláně-chemické vlastnosti (rozpustnost ve vodě, tlak par, rozdělovací koeficient v půdě (případně v sedimentu), stabilita ve vodě atd.,
|
|
—
|
chemické identifikační údaje (obecný název, chemický název, strukturní vzorec, číslo CAS atd.) včetně čistoty a analytické metody pro kvantitativní stanovení zkoušené látky.
|
|
|
|
Testovací druh:
|
—
|
užitá pokusná zvířata: druh, vědecký název, zdroj organismů a podmínky množení,
|
|
—
|
informace o nakládání se shluky vajíček a s larvami,
|
|
—
|
stáří testovaných zvířat po nasazení do zkušebních nádob.
|
|
|
|
Zkušební podmínky:
|
—
|
použitý sediment, tj. přírodní nebo přísadami doplněný sediment,
|
|
—
|
u přírodního sedimentu lokalita a popis místa odběru sedimentu, pokud možno včetně dřívější kontaminace, charakteristiky: pH, obsah organického uhlíku, poměr C/N a zrnitost (je-li to vhodné),
|
|
—
|
příprava přísadami doplněného sedimentu: složky a charakteristiky (obsah organického uhlíku, pH, vlhkost, atd. na začátku zkoušky),
|
|
—
|
příprava zkušební vody (pokud se používá rekonstituovaná voda) a její charakteristiky (koncentrace kyslíku, pH, vodivost, tvrdost, atd. na začátku zkoušky),
|
|
—
|
hloubka sedimentu a vody nad sedimentem,
|
|
—
|
objem vody nad sedimentem a kapilární vody, hmotnost vlhkého sedimentu s kapilární vodou a bez ní,
|
|
—
|
zkušební nádoby (materiál a rozměry),
|
|
—
|
způsob vmíchávání do sedimentu, použité zkušební koncentrace, počet duplikátních vzorků a případné použití rozpouštědla,
|
|
—
|
stabilizace rovnovážné fáze obohaceného systému sediment/voda: trvání a podmínky,
|
|
—
|
inkubační podmínky: teplota, cyklus a intenzita světla, provzdušňování (frekvence a intenzita),
|
|
—
|
podrobnější informace o krmení včetně typu krmiva, přípravy, množství a režimu krmení.
|
|
|
|
Výsledky:
|
—
|
nominální zkušební koncentrace, naměřené zkušební koncentrace a výsledky všech analýz pro stanovení koncentrace zkoušené chemické látky ve zkušební nádobě,
|
|
—
|
jakost vody ve zkušebních nádobách, tj. pH, teplota, rozpuštěný kyslík, tvrdost a amoniak,
|
|
—
|
případné nahrazování odpařené zkušební vody,
|
|
—
|
počet vylíhlých samců a samic pakomárů na nádobu za den,
|
|
—
|
počet larev, z nichž se nevylíhli dospělci, na nádobu,
|
|
—
|
průměrná individuální hmotnost sušiny larev na nádobu a případně na instar,
|
|
—
|
procento vylíhlých jedinců na duplikátní vzorek a zkušební koncentraci (směsný vzorek samců a samic pakomárů),
|
|
—
|
průměrná rychlost vývoje plně vylíhlých pakomárů na duplikátní vzorek a aplikované množství (směsný vzorek samců a samic pakomárů),
|
|
—
|
odhady koncových bodů toxicity, např. ECx (a související intervaly spolehlivosti), NOEC a/nebo LOEC a statistické metody použité k jejich stanovení,
|
|
—
|
diskuse o výsledcích včetně případného vlivu na výsledek zkoušky v důsledku odchylek od této zkušební metody.
|
|
|
LITERATURA:
|
1)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke and H.Köpp. Berlin 1995.
|
|
2)
|
Fleming R et al. (1994). Sediment Toxicity Tests for Poorly Water-Soluble Substances. Final Report to them European Commission. Report No: EC 3738. August 1994. WRc, UK.
|
|
3)
|
SETAC (1993). Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments. From the WOSTA Workshop held in the Netherlands.
|
|
4)
|
ASTM International/E1706-00 (2002). Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates. pp 1125–1241. In ASTM International 2002 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM. International, West Conshohocken, PA.
|
|
5)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. Prosinec 1997.
|
|
6)
|
US-EPA (2000). Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates. Second edition. EPA 600/R-99/064. March 2000. Revision to the first edition dated June 1994.
|
|
7)
|
US-EPA/OPPTS 850.1735. (1996): Whole Sediment Acute Toxicity Invertebrates.
|
|
8)
|
US-EPA/OPPTS 850.1790. (1996): Chironomid Sediment toxicity Test.
|
|
9)
|
Milani D, Day KE, McLeay DJ, and Kirby RS (1996). Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada’s biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius). Technical Report. Environment Canada. National Water Research Institute. Burlington, Ontario, Canada.
|
|
10)
|
Sugaya Y (1997). Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui. Jp. J. Sanit. Zool. 48 (4): 345–350.
|
|
11)
|
Kawai K (1986). Fundamental studies on Chironomid allergy. I. Culture methods of some Japanese Chironomids (Chironomidae, Diptera). Jp. J. Sanit. Zool. 37(1): 47–57.
|
|
12)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
13)
|
Environment Canada (1995). Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant. Report EPS 1/RM/30. September 1995.
|
|
14)
|
Zkušební metoda C.8 této přílohy, Toxicita pro žížaly.
|
|
15)
|
Suedel BC and JH Rodgers (1994). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13: 1163–1175.
|
|
16)
|
Naylor C and C Rodrigues (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291–3303.
|
|
17)
|
Dunnett CW (1964). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096–1121.
|
|
18)
|
Dunnett CW (1964). New tables for multiple comparisons with a control. Biometrics, 20: 482–491.
|
|
19)
|
Williams DA (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103–117.
|
|
20)
|
Williams DA (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28: 510–531.
|
|
21)
|
Rao JNK and Scott AJ (1992). A simple method for the analysis of clustered binary data. Biometrics 48: 577–585.
|
|
22)
|
Christensen ER (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18: 213–221.
|
|
23)
|
Bruce and Versteeg (1992). A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11: 1485–1494.
|
|
24)
|
Slob W (2002). Dose-response modelling of continuous endpoints. Toxicol. Sci. 66: 298–312.
|
Dodatek 1
DEFINICE
Pro účely této zkušební metody se použijí tyto definice:
|
|
Přísadami doplněný sediment nebo rekonstituovaný, umělý nebo syntetický sediment je směs materiálů užitá k napodobení fyzických složek přírodního sedimentu.
|
|
|
Voda nad sedimentem je voda nacházející se nad sedimentem ve zkušební nádobě.
|
|
|
Intersticiální voda nebo kapilární voda je voda zabírající prostor mezi sedimentem a částicemi půdy.
|
|
|
Obohacený sediment je sediment, do něhož byla přidána zkoušená látka.
|
|
|
Zkoušená chemická látka: jakákoli látka nebo směs testovaná pomocí této zkušební metody.
|
Dodatek 2
Doporučení pro kultivaci kultury Chironomus riparius
|
1.
|
Larvy rodu Chironomus lze chovat v krystalizačních miskách nebo ve větších nádobách. Jemný křemičitý písek se rozprostře po dně nádoby v tenké vrstvě silné 5 až 10 mm. Bylo prokázáno, že substrátem vhodným jako podklad je také křemelina (např. Merck, čl. 8117), (dostačující je tenčí vrstva silná jen několik málo mm). Následně se přidá několikacentimetrová vrstva vhodné vody. Objem vody by se měl podle potřeby doplňovat s cílem nahradit ztráty vzniklé odpařováním a zabránit vysychání. Vodu lze v případě potřeby vyměnit. Je třeba zajistit mírné provzdušňování. Nádoby, v nichž jsou larvy chovány, by měly být umístěny ve vhodné kleci, která zabrání úniku líhnoucích se dospělců. Tato klec by měla být dostatečně velká, aby umožňovala rojení vylíhlých dospělců, jinak by nemuselo dojít k jejich páření (minimum je přibližně 30 × 30 × 30 cm).
|
|
2.
|
Klece by měly být umístěny při pokojové teplotě nebo v místnosti s konstantní teplotou 20 ± 2 °C s fotoperiodou 16 hodin světlo (intenzity přibližně 1 000 lux) a 8 hodin tma. Bylo zjištěno, že vzdušná vlhkost nižší než 60 % RH může bránit rozmnožování.
|
Ředicí voda
|
3.
|
Lze použít jakoukoli vhodnou přírodní nebo syntetickou vodu. Zpravidla se užívá studniční voda, odchlorovaná vodovodní voda a umělá média (např. Elendtovo médium „M4“ nebo „M7“, viz níže). Vodu je před použitím nutno provzdušnit. Je-li to nutné, lze kultivační vodu obnovit opatrným odlitím nebo odčerpáním použité vody z kultivačních nádob tak, aby nedošlo k poškození schránek larev.
|
Krmení larev
|
4.
|
Larvy rodu Chironomus se krmí vločkovým krmivem pro ryby (TetraMin(®, Tetra Phyll® nebo jiná podobná značka patentovaného krmiva pro ryby), v množství přibližně 250 mg na nádobu a den. Potravu lze aplikovat v podobě suchého mletého prášku nebo v podobě suspenze ve vodě: 1,0 g vločkového krmiva se přidá do 20 ml ředicí vody a vytvoří se homogenní směs. Tento přípravek lze dodávat v množství přibližně 5 ml na nádobu na den (před použitím protřepat). Starším larvám lze přidat více krmiva.
|
|
5.
|
Krmení se upraví podle kvality vody. V případě, že se kultivační médium „zakalí“, je třeba krmnou dávku snížit. Přidávání potravy je nutno pečlivě sledovat. Příliš malé množství krmiva způsobí, že larvy opouštějí sediment a vznášejí se ve vodním sloupci, a příliš mnoho krmiva způsobí zvýšenou mikrobiální činnost a pokles koncentrace kyslíku. Obojí může způsobit snížení rychlosti růstu.
|
|
6.
|
Do nových kultivačních nádob mohou být přidány i buňky zelených řas (např. Scenedesmus subspicatus, Chlorella vulgaris).
|
Krmení vylíhlých dospělců
|
7.
|
Někteří experimentátoři se domnívají, že jako potrava vylíhlých dospělců může sloužit vata namočená do nasyceného roztoku sacharózy.
|
Líhnutí
|
8.
|
Dospělci se začnou v chovných nádobách líhnout při teplotě 20 ± 2 °C přibližně po 13–15 dnech. Samce lze snadno rozlišit podle vějířovitých tykadel.
|
Shluky vajíček
|
9.
|
Jakmile se ve snubní komůrce nacházejí dospělci, je třeba třikrát týdně kontrolovat všechny reprodukční nádoby, zda se v nich nacházejí shluky vajíček spojené želatinózní hmotou. Pokud se zde shluky vajíček nacházejí, je nutno je opatrně odstranit a přemístit do malé misky obsahující vzorek chovného vodního prostředí. Shluky vajíček se užijí pro založení nové nádoby s kulturou (např. 2–4 shluky vajíček na nádobu) nebo se užijí pro zkoušky toxicity.
|
|
10.
|
Larvy prvního instarového stadia by se měly vylíhnout za 2–3 dny.
|
Zakládání nových kultivačních nádob
|
11.
|
Jakmile jsou kultury založeny, mělo by být možné zakládat nové nádoby s kulturami larev jednou týdně nebo méně často v závislosti na zkušebních požadavcích a odstraňovat starší nádoby po vylíhnutí dospělců. Pomocí tohoto systému se zajistí pravidelné dodávky dospělců s minimální potřebou dohledu.
|
Příprava zkušebních roztoků „M4“ a „M7“
|
12.
|
Elendt (1990) popsal médium „M4“. Médium „M7“ se připraví obdobně jako médium „M4“ s výjimkou látek uvedených v tabulce 1, u nichž jsou koncentrace u „M7“ čtyřikrát nižší než u „M4“. Připravuje se publikace o médiu „M7“ (Elendt, osobní sdělení). Podle Elendta a Biase (1990) by se zkušební roztok neměl připravovat pro koncentrace NaSiO3 5 H2O, NaNO3, KH2PO4 a K2HPO4 vzhledem k tomu, že nejsou pro přípravu zásobních roztoků vyhovující.
|
Příprava média „M7“
|
13.
|
Každý zásobní roztok (I) se připraví samostatně a z těchto zásobních roztoků (I) se pak připraví kombinovaný zásobní roztok (II) (viz tabulka 1). Médium „M7“ se připraví přidáním 50 ml kombinovaného zásobního roztoku (II) a množství zásobního roztoku jednotlivých makroživin, které jsou uvedeny v tabulce 2, do 1 litru deionizované vody. Připraví se vitaminový zásobní roztok přidáním tří vitaminů do deionizované vody, jak je uvedeno v tabulce 3, a 0,1 ml kombinovaného vitaminového zásobního roztoku se přidá do výsledného média „M7“ krátce před použitím. (Vitaminový zásobní roztok se uskladňuje zmrazený v malých alikvotních dílech.) Médium se provzdušní a stabilizuje.
|
LITERATURA:
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke and H.Köpp. Berlin 1995.
Tabulka 1
Zásobní roztoky stopových prvků pro médium M4 a M7
|
Zásobní roztoky (I)
|
Množství (mg) doplněné na 1 litr deionizované vody
|
Kombinovaný zásobní roztok (II) se připraví smícháním následujících množství (v ml) zásobních roztoků (I) a doplněním na 1 litr deionizované vody
|
Konečné koncentrace ve zkušebním roztoku (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(15)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4 H2O (15)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (15)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (15)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6 H2O (15)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (15)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2 H2O (15)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2 H2O (15)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6 H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2 H2O (15)
(16)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7 H2O (15)
(16)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tabulka 2
Zásobní roztoky makroživin pro médium M4 a M7
|
|
Množství doplněné na 1 litr deionizované vody
(mg)
|
Množství zásobních roztoků makroživin přidané za účelem přípravy média M4 a M7
(ml/l)
|
Konečné koncentrace ve zkušebním roztoku M4 a M7
(mg/l)
|
|
CaCl2 · 2 H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7 H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9 H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tabulka 3
Vitaminový zásobní roztok pro médium M4 a M7. Všechny tři vitaminové roztoky se smísí do jediného vitaminového zásobního roztoku
|
|
Množství doplněné na 1 litr deionizované vody
(mg)
|
Množství vitaminového zásobního roztoku přidané za účelem přípravy média M4 a M7
(ml/l)
|
Konečné koncentrace ve zkušebním roztoku M4 a M7
(mg/l)
|
|
Thiaminhydrochlorid
|
750
|
0,1
|
0,075
|
|
Kyanokobalamin (B12)
|
10
|
0,1
|
0,0010
|
|
Biotin
|
7,5
|
0,1
|
0,00075
|
LITERATURA:
Elendt, B.P. (1990). Selenium Deficiency in Crustacean. Protoplasma 154: 25–33.
Elendt, B.P. & W.-R. Bias (1990). Trace Nutrient Deficiency in Daphnia magna Cultured in Standard Medium for Toxicity Testing. Effects on the Optimization of Culture Conditions on Life History Parameters of D. magna. Water Research 24 (9): 1157–1167.
Dodatek 3
PŘÍPRAVA PŘÍSADAMI DOPLNĚNÉHO SEDIMENTU
Složení sedimentu
Složení přísadami doplněného sedimentu by mělo být následující:
|
Složka
|
Charakteristika
|
% sušiny
sedimentu
|
|
Rašelina:
|
rašelina mechu Sphagnum s pH co nejblíže 5,5 až 6,0, bez viditelných zbytků rostlin a jemně mletá (velikost částic ≤ 1 mm) a vysušená na vzduchu
|
4–5
|
|
Křemičitý písek
|
velikost zrn: > 50 % částic musí být v rozpětí 50–200 μm
|
75–76
|
|
Kaolinitický jíl
|
obsah kaolinitu ≥ 30 %
|
20
|
|
Organický uhlík
|
upraven přidáním rašeliny a písku
|
2 (± 0,5)
|
|
Uhličitan vápenatý
|
CaCO3, práškový, chemicky čistý
|
0,05–0,1
|
|
Voda
|
vodivost ≤ 10 μS/cm
|
30–50
|
Příprava
Rašelina se usuší na vzduchu a rozemele se na jemný prášek. Připraví se suspenze požadovaného množství rašelinného prášku v deionizované vodě s použitím vysoce výkonného homogenizačního zařízení. pH této suspenze se upraví na 5,5 ± 0,5 pomocí CaCO3. Suspenze se kondicionuje po dobu nejméně dvou dní za mírného promíchávání při 20 ±2° C za účelem stabilizace pH a vytvoření stabilní mikrobiální složky. Poté se opět změří pH, které by se mělo rovnat 6,0 ± 0,5. Pak se suspenze rašeliny smísí s ostatními složkami (písek a kaolín) a s deionizovanou vodou s cílem získat homogenní sediment s obsahem vody v rozmezí 30–50 procent sušiny sedimentu. Znovu se změří pH konečné směsi a v případě nutnosti je opět upraveno pomocí CaCO3 na hodnotu 6,5 až 7,5. Odeberou se vzorky sedimentu pro stanovení obsahu sušiny a obsahu organického uhlíku. Následně se doporučuje před použitím pro zkoušku toxicity pro pakomáry přísadami doplněný sediment kondicionovat po dobu sedmi dnů za stejných podmínek, které převládají v následné zkoušce.
Skladování
Suché složky pro přípravu umělého sedimentu lze skladovat na suchém a chladném místě při pokojové teplotě. Přísadami doplněný (mokrý) sediment by neměl být před použitím ve zkoušce skladován. Měl by být použit ihned po uplynutí sedmidenního období kondicionování, kterým končí jeho příprava.
LITERATURA:
Kapitola C.8 této přílohy. Toxicita pro žížaly.
Meller M, Egeler P, Rombke J, Schallnass H, Nagel R, Streit B (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulfate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety 39: 10–20.
Dodatek 4
Chemické charakteristiky přípustné ředicí vody
|
Látka
|
Koncentrace
|
|
Částice tuhé
|
< 20 mg/l
|
|
Celkový obsah organického uhlíku
|
< 2 mg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Tvrdost jako CaCO3
|
< 400 mg/l (17)
|
|
Zbytkový chlor
|
< 10 μg/l
|
|
Celkové organické fosforové pesticidy
|
< 50 ng/l
|
|
Celkové organické chlorové pesticidy a polychlorované bifenyly
|
< 50 ng/l
|
|
Celkový organický chlor
|
< 25 ng/l
|
Dodatek 5
Pokyny pro monitorování líhnutí larev pakomárů
Na zkušební kádinky jsou umístěny výletové pasti. Tyto pasti jsou potřebné od 20. dne až do konce zkoušky. Níže je nakreslen příklad používané pasti:
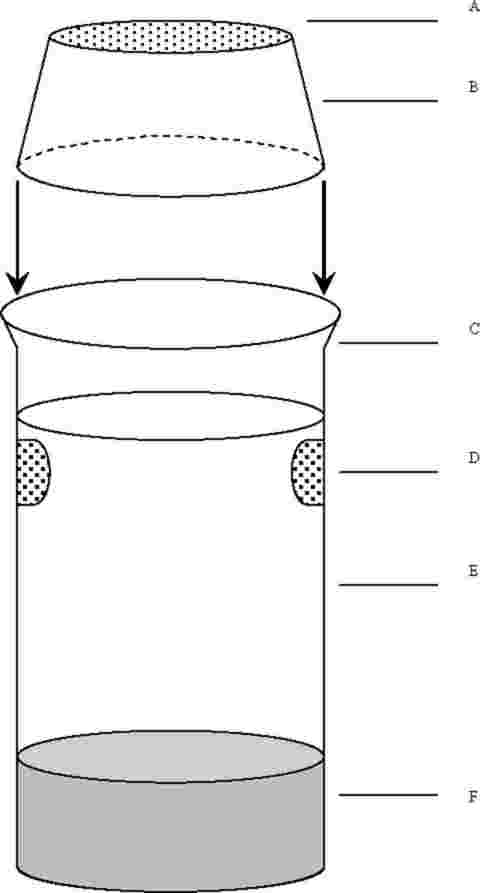
A: nylonová síťka
B: plastový kryt
C: kádinka bez zobáčku
D: otvory na výměnu vody
E: voda
F: sediment
C.28 TEST TOXICITY NA CHIRONOMIDAE V SYSTÉMU SEDIMENT–VODA ZA POUŽITÍ OBOHACENÉ VODY
ÚVOD
|
1.
|
Tato zkušební metoda odpovídá pokynu OECD pro zkoušení (TG) 219 (2004). Tato zkušební metoda je určena k posouzení účinků dlouhodobé expozice larev sladkovodních pakomárů Chironomus sp. žijících v sedimentu chemickým látkám. Je založena především na pokynu BBA s užitím zkušebního systému sediment-voda s umělou půdou a scénáře expozice vodního sloupce (1). Zohledňuje rovněž stávající protokoly o zkouškách toxicity pro Chironomus riparius a Chironomus tentans, které byly vyvinuty v Evropě a Severní Americe a (2, 3, 4, 5, 6, 7, 8) a zkoušeny v mezilaboratorních porovnávacích zkouškách (1, 6, 9). Lze užít rovněž další dobře zdokumentované druhy pakomárů, jako například Chironomus yoshimatsui (10, 11).
|
|
2.
|
Scénář expozice užitý při této zkušební metodě spočívá v obohacení vody. Výběr vhodného scénáře expozice závisí na zamýšleném použití testu. Účelem scénáře expozice vody, který zahrnuje obohacení vodního sloupce, je simulovat rozprášení pesticidního postřiku a zahrnuje počáteční maximální koncentrace v kapilární vodě. Je vhodný také pro jiné druhy expozic (včetně úniků chemikálií) s výjimkou akumulačních procesů, jejichž délka přesahuje trvání zkušebního období.
|
|
3.
|
Látky, které je třeba testovat z hlediska organismů žijících v sedimentu, v této složce obvykle přetrvávají po dlouhá časová období. Expozici organismů žijících v sedimentu lze zajistit celou řadou možných cest. Relativní význam jednotlivých cest, jimiž dochází k expozici, a doba nezbytná k tomu, aby každá z nich přispěla k celkovým toxickým účinkům, je závislá na fyzikálně chemických vlastnostech dotčené chemické látky. V případě silně adsorbujících látek (např. log Kow > 5) nebo pro chemické látky s kovalentní vazbou na sediment může být významnou expoziční cestou požití kontaminované potravy. Aby nedošlo k podcenění toxicity vysoce lipofilních látek, lze zvážit užití potravy přidané do sedimentu před aplikací zkoušené chemické látky. Aby bylo možné zohlednit všechny potenciální způsoby expozice, zaměřuje se tato zkušební metoda na dlouhodobou expozici. Délka trvání zkoušky se pohybuje v rozmezí 20–28 dní pro C. riparius and C. yoshimatsui a 28–65 dní pro C. tentans. Pokud jsou pro konkrétní účel, například pro studium účinků nestabilní chemické látky, potřebné krátkodobé údaje, mohou být další duplikátní vzorky po deseti dnech odstraněny.
|
|
4.
|
Měřené výsledné účinky se rovnají celkovému počtu vylíhlých dospělců a času do vylíhnutí. Pokud jsou nezbytné další krátkodobé údaje, doporučuje se provádět měření přežití a růstu larev až po uplynutí desetidenního období, podle potřeby s využitím dalších duplikátních vzorků.
|
|
5.
|
Doporučuje se použití přísadami doplněného sedimentu. Přísadami doplněný sediment má několik výhod oproti přírodním sedimentům:
|
—
|
jeho experimentální variabilita je snížena, protože tvoří reprodukovatelnou „standardizovanou matrici“, a odpadá potřeba hledat zdroje nekontaminovaného čistého sedimentu,
|
|
—
|
zkoušky lze zahájit kdykoliv, aniž by bylo nutné čelit sezónním výkyvům zkušebního sedimentu, a sediment není třeba předem upravit s cílem odstranit původní živočichy; užití přísadami doplněného sedimentu také snižuje náklady spojené s terénním shromažďováním dostatečného množství sedimentu pro rutinní testování,
|
|
—
|
užití přísadami doplněného sedimentu umožňuje porovnání toxicity a odpovídající řazení látek; údaje o toxicitě ze zkoušek s přírodními a umělými sedimenty byly pro více látek porovnatelné (2).
|
|
|
6.
|
Použité definice jsou uvedeny v dodatku 1.
|
PODSTATA ZKOUŠKY
|
7.
|
Larvy pakomárů jsou během prvního instaru vystaveny koncentračnímu rozmezí zkoušené chemické látky v systému sediment-voda. Zkouška začíná tím, že se larvy prvního instaru nasadí do zkušebních kádinek obsahujících systém sediment-voda a voda se následně obohatí zkoušenou látkou. Na konci zkoušky se měří počet vylíhnutí a rychlost vývoje pakomárů. V případě potřeby lze po 10 dnech měřit rovněž přežití larev a jejich hmotnost (v případě potřeby lze použít další duplikátní vzorky). Tyto údaje se analyzují buď pomocí regresního modelu s cílem odhadnout koncentraci, která by způsobila x% snížení líhnutí nebo přežití či růstu larev (např. EC15, EC50, atd.), nebo s využitím testování statistických hypotéz pro stanovení NOEC/LOEC. Posledně uvedená metoda vyžaduje srovnání hodnoty účinku s kontrolními hodnotami pomocí statistických testů.
|
INFORMACE O ZKOUŠENÉ LÁTCE
|
8.
|
Měla by být známa rozpustnost zkoušené chemické látky ve vodě, její tlak par, naměřená nebo vypočtená distribuce v sedimentu a stabilita ve vodě a sedimentu. Měla by být k dispozici spolehlivá analytická metoda pro kvantitativní stanovení zkoušené chemické látky ve vodě nad sedimentem, kapilární vodě a v sedimentu, a to se známou a doloženou přesností a mezí stanovitelnosti. Užitečné informace zahrnují strukturní vzorec a čistotu zkoušené chemické látky. Užitečnou informací je rovněž chemický osud zkoušené chemické látky (např. zánik, abiotický a biotický rozklad atd.) Další návod pro zkoušení látek s fyzikálně chemickými vlastnostmi, které činí jejich zkoušení obtížné, je uveden v odstavci (12).
|
REFERENČNÍ CHEMICKÉ LÁTKY
|
9.
|
Referenční chemické látky mohou být pravidelně kontrolovány pro ověření, že zkušební podmínky a protokol o zkoušce jsou spolehlivé. Příkladem referenčních toxických látek úspěšně použitých v mezilaboratorních zkouškách a validačních studiích jsou lindan, trifluralin, pentachlorfenol, chlorid kademnatý a chlorid draselný (1, 2, 5, 6, 13).
|
PLATNOST ZKOUŠKY
|
10.
|
Aby byla zkouška platná, měly by být splněny tyto podmínky:
|
—
|
vylíhnutí v kontrolních nádobách musí být na konci zkoušky nejméně 70 % (1, 6),
|
|
—
|
k líhnutí dospělců C. riparius and C. yoshimatsui v kontrolních nádobách by mělo dojít mezi 12. a 23. dnem po jejich zavedení do nádob; pro C. tentans je nutná doba 20–65 dnů,
|
|
—
|
na konci zkoušky se v každé nádobě změří pH a koncentrace rozpuštěného kyslíku. Koncentrace kyslíku by měla činit alespoň 60 procent hodnoty nasycení vzduchem (ASV), při použité teplotě, a pH vody nad sedimentem by se mělo ve všech zkušebních nádobách pohybovat v rozmezí pH 6–9,
|
|
—
|
teplota vody by se neměla lišit o více než ± 1,0 °C. Teplota vody může být řízena v izotermální místnosti a v tomto případě by měla být teplota v místnosti ve vhodném časovém intervalu potvrzována.
|
|
POPIS METODY
Zkušební nádoby
|
11.
|
Studie se provádí ve skleněných 600ml kádinkách o průměru 8 cm. Vhodné jsou i jiné nádoby, ale měly by zaručit odpovídající hloubku vody nad sedimentem a sedimentu. Plocha sedimentu by měla být dostatečná, aby poskytovala 2 až 3 cm2 na larvu. Poměr hloubky sedimentu k hloubce vody nad sedimentem by měl být 1:4. Zkušební nádoby a další aparatura, která přichází do styku se zkušebním systémem, by měly být celé zhotoveny ze skla nebo z jiného chemicky inertního materiálu (např. z teflonu).
|
Výběr druhů
|
12.
|
Při zkoušce má být přednostně užito druhu Chironomus riparius. Vhodný je i druh Chironomus tentans, avšak hůře se s ním manipuluje a vyžaduje i delší trvání zkoušky. Lze užít rovněž druh Chironomus yohimatsui. Podrobnosti o kultivačních metodách pro druh Chironomus riparius jsou uvedeny v dodatku 2. Informace o kultivačních podmínkách jsou k dispozici také pro jiné druhy, tj. Chironomus tentans (4) a Chironomus yoshimatsui (11). Identifikace druhu musí být potvrzena před zkouškou, ale není vyžadována před každou zkouškou, pokud organismy pocházejí z domácí kultury.
|
Sediment
|
13.
|
Doporučuje se přednostně užívat přísadami doplněný sediment (nazývaný rovněž rekonstituovaný, umělý nebo syntetický sediment). Pokud se však použije přírodní sediment, je potřeba ho charakterizovat (alespoň pH, obsah organického uhlíku a doporučuje se i stanovení dalších parametrů, jako je poměr C/N a zrnitost) a měl by být prost veškerého znečištění a dalších organismů, které by mohly pakomárům konkurovat nebo je konzumovat. Doporučuje se také přírodní sediment před použitím při zkoušce toxicity pro pakomáry kondicionovat po dobu sedmi dnů za stejných podmínek, které převládají v následující zkoušce. Pro použití v této zkoušce se doporučuje následující přísadami doplněný sediment založený na umělé půdě užité při zkušební metodě C.8 (14) (1, 15, 16):
|
a)
|
4–5 % (sušiny) rašeliny s pH co nejblíže 5,5 až 6,0; ve formě prášku, jemně namletá (velikost částic ≤ 1 mm) a vysušená výhradně na vzduchu;
|
|
b)
|
20 % (sušiny) kaolinitického jílu (pokud možno s více než 30 % kaolinitu);
|
|
c)
|
75–76 % (sušiny) křemenného písku (měl by převažovat jemný písek s více než 50 % částic velikosti 50 až 200 μm);
|
|
d)
|
přidá se deionizovaná voda s cílem dosáhnout 30–50 % vlhkosti v konečné směsi;
|
|
e)
|
přidá se chemicky čistý uhličitan vápenatý (CaCO3) pro úpravu pH konečné směsi sedimentu na pH 7,0 ± 0,5;
|
|
f)
|
obsah organického uhlíku v konečné směsi by měl být 2 % (± 0,5 %) a je třeba jej upravit použitím vhodného množství rašeliny a písku v souladu s písm. a) a c).
|
|
|
14.
|
Rašelina, kaolinitický jíl a písek by měly pocházet ze známého zdroje. Jednotlivé složky sedimentu by měly být kontrolovány z hlediska nepřítomnosti chemické kontaminace (např. těžké kovy, chlorované organické sloučeniny, organofosforové sloučeniny atd.). Příklad přípravy přísadami doplněného sedimentu je popsán v dodatku 3. Přijatelné je i míchání suchých složek, pokud se prokáže, že po přidání vody nad sedimentem nedochází k separaci složek sedimentu (např. vyplavování částic rašeliny) a že rašelina nebo sediment jsou dostatečně kondicionovány.
|
Voda
|
15.
|
Pro tuto zkoušku je vhodná jakákoli voda, která vyhovuje chemickým charakteristikám přípustné ředicí vody uvedeným v dodatcích 2 a 4. Jakákoli vhodná voda, přírodní voda (povrchová nebo podzemní), rekonstituovaná voda (viz příloha 2) nebo odchlorovaná vodovodní voda je přijatelná jako kultivační a zkušební voda, pokud v ní pakomáři přežijí po dobu kultivace a zkoušení bez známek stresu. Na začátku zkoušky by se hodnota pH zkušební vody měla pohybovat mezi 6 a 9 a její celková tvrdost by neměla být vyšší než 400 mg/l CaCO3. V případě, že je podezření na interakci mezi ionty způsobujícími tvrdost vody a zkoušenou látkou, měla by však být použita voda nižší tvrdosti (a proto se v této situaci nesmí použít Elendtovo médium M4). V průběhu celé studie by měl být užíván stejný typ vody. Charakteristiky jakosti vody uvedené v dodatku 4 by měly být měřeny nejméně dvakrát ročně, nebo pokud existuje podezření, že mohlo dojít k podstatné změně těchto vlastností.
|
Zásobní roztoky – obohacená voda
|
16.
|
Zkušební koncentrace se vypočtou na základě koncentrace vodního sloupce, tj. vody nad sedimentem. Zkušební roztoky zvolené koncentrace jsou obvykle připraveny ředěním zásobního roztoku. Zásobní roztoky by měly být připraveny přednostně rozpuštěním zkoušené látky ve zřeďovací vodě. Použití rozpouštědel nebo dispergátorů může být v některých případech pro vytvoření zásobního roztoku o vhodné koncentraci nezbytné. Ke vhodným rozpouštědlům patří aceton, ethanol, methanol, ethylenglykol-monoethylether, ethylenglykol-dimethylether, dimethylformamid a triethylenglykol. Disperzní činidla, která mohou být použita, jsou Cremophor RH40, Tween 80, 0,01 % methylcelulosa a HCO-40. Koncentrace solubilizačního činidla v konečném zkušebním médiu by měla být minimální (tj. ≤ 0,1 ml/l) a měla by být u všech expozic stejná. Je-li použito solubilizační činidlo, nesmí mít významné účinky na přežití ani viditelné nepříznivé účinky na larvy Chironomidae, což musí být prokázáno na kontrolní skupině vystavené pouze rozpouštědlu. Měla by však být vynaložena maximální snaha takové chemické látky nepoužívat.
|
USPOŘÁDÁNÍ ZKOUŠKY
|
17.
|
Uspořádáním zkoušky se rozumí výběr počtu zkušebních koncentrací a jejich odstupňování, počet nádrží pro každou koncentraci a počet larev v nádrži. Jsou popsána uspořádání pro odhad koncentrace vyvolávající účinek EC, odhad NOEC a pro provedení limitní zkoušky. Regresní analýze se dává přednost před testováním hypotéz.
|
Uspořádání pro regresní analýzu
|
18.
|
Koncentrace použité ve zkoušce musí v každém případě pokrývat koncentraci vyvolávající účinek (např. EC15, EC50) a rozsah koncentrací, při nichž dochází k účinku, který je předmětem zájmu. Obecně platí, že přesnost, a zejména platnost, s níž lze provést odhady koncentrace vyvolávající účinek (ECx), se zvýší, pokud se daná koncentrace vyvolávající účinek nachází v rozmezí zkoušených koncentrací. Je třeba se vyhnout extrapolaci hluboko pod nejnižší pozitivní koncentrací nebo přesahující nejvyšší koncentraci. Předběžná orientační zkouška je užitečná pro výběr rozsahu koncentrací, které mají být použity (viz odstavec 27).
|
|
19.
|
V případě, že ECx je třeba odhadnout, je třeba zkoušku provést alespoň v pěti koncentracích a třech opakováních pro každou koncentraci. V každém případě je vhodné, aby byly užity dostatečné zkušební koncentrace umožňující dobrý odhad modelu. Faktor mezi koncentracemi nesmí být větší než 2 (výjimku lze učinit v případech, kdy má křivka závislosti odezvy na dávce malý sklon). Počet opakování při každé expozici lze snížit, pokud se zvýší počet zkušebních koncentrací s různými odezvami. Zvýšení počtu opakování nebo zúžení rozsahu zkušebních koncentrací obvykle vede k zúžení intervalu spolehlivosti zkoušky. Pro odhad desetidenního přežití a růstu larev jsou nutná další opakování.
|
Uspořádání odhadu NOEC/LOEC
|
20.
|
Pro odhad LOEC/NOEC se použije pět zkušebních koncentrací s nejméně čtyřmi opakováními a faktor mezi koncentracemi by neměl být vyšší než 2. Počet opakování by měl být dostatečný, aby zajistil odpovídající statistickou významnost, s jakou má být rozeznán 20 % rozdíl oproti kontrolnímu vzorku na 5 % hladině významnosti (p = 0,05). Pro rychlost vývoje je zpravidla vhodné použít analýzu rozptylu (ANOVA), jako například Dunnettův nebo Williamsův test (17, 18, 19, 20). Pro procento vylíhlých jedinců lze použít Cochranův-Armitageův test, Fisherův exaktní test (s Bonferroniho korekcí) nebo Mantelův-Haenszelův test.
|
Limitní zkouška
|
21.
|
Limitní zkouška může být provedena (jedna zkušební koncentrace a kontrola), pokud nebyl zjištěn žádný dopad při předběžné orientační zkoušce. Účelem limitní zkoušky je určit, že hodnota toxicity zkoušené látky je vyšší než zkoušený koncentrační limit. V této zkušební metodě nelze navrhnout doporučenou koncentraci: její stanovení je ponecháno na úsudku osob s rozhodovací pravomocí. Obvykle je pro expozici i kontrolu zapotřebí alespoň šesti opakování. Počet opakování by měl být dostatečný, aby zajistil odpovídající statistickou významnost, s jakou má být rozeznán 20 % rozdíl oproti kontrolnímu vzorku na 5 % hladině významnosti (p = 0,05). S metrickou reakcí (rychlost vývoje a hmotnost), je t-test vhodnou statistickou metodou, pokud údaje splňují požadavky tohoto testu (normalita, homogenní rozptyly). Pokud tyto požadavky splněny nejsou, lze použít t-test nestejných rozptylů nebo neparametrický test, jako je například Wilcoxon-Mann-Whitneyův test. Pro procento vylíhlých jedinců je vhodný Fisherův exaktní test.
|
POSTUP
Podmínky expozice
Příprava systému obohacená voda–sediment
|
22.
|
Do zkušebních nádob se přidá vhodné množství přísadami doplněného sedimentu (viz odstavce 13–14 a dodatek 3) tak, aby tvořil vrstvu o hloubce nejméně 1,5 cm. Přidá se voda do hloubky 6 cm (viz odstavec 15). Poměr vrstvy sedimentu a hloubky vody by neměl překročit 1:4 a vrstva sedimentu by neměla být hlubší než 3 cm. Systém sediment–voda se před přidáním zkušebních organismů (viz odstavec 14 a dodatek 3). mírně provzdušňuje po dobu sedmi týdnů. Aby se zabránilo oddělení složek sedimentu a resuspenzi jemného materiálu v průběhu přidávání zkušební vody ve vodním sloupci, lze sediment přikrýt plastovým diskem, na který se voda nalije a disk se bezprostředně poté vyjme. Mohou být vhodná i jiná zařízení.
|
|
23.
|
Zkušební nádoby se přikryjí (například skleněnými víčky). Pokud je to nutné, v průběhu studie se hladina vody doplní na původní objem s cílem kompenzovat odpařování vody. K tomuto účelu by měla být použita destilovaná nebo deionizovaná voda, aby se zabránilo hromadění solí.
|
Přidání zkušebních organismů
|
24.
|
Čtyři až pět dnů před přidáním zkušebních organismů do zkušebních nádob by měly být z kultur odebrány shluky vajíček a umístěny do malých nádob do kultivačního média. Lze použít starší médium ze zásobní kultury nebo čerstvě připravené médium. Pokud je použito čerstvé médium, mělo by být do kultivačního média přidáno malé množství potravy, např. zelené řasy a/nebo několik kapek filtrátu z jemně mleté suspenze vločkového krmiva pro ryby (viz dodatek 2). Měly by být použity pouze čerstvě nakladené shluky vajíček. Za normálních okolností se larvy začínají líhnout několik dní po nakladení vajíček (2 až 3 dny u Chironomus riparius při 20 °C a 1 až 4 dny u Chironomus tentans při 23 °C a Chironomus yoshimatui při 25 °C) a během larválního vývoje se vystřídají čtyři instary, z nichž každý trvá 4–8 dnů. Při zkoušce se použijí larvy prvního instaru (2–3 nebo 1–4 dnů po vylíhnutí). Instar pakomárů lze případně zkontrolovat pomocí šířky hlavové kapsuly (6).
|
|
25.
|
Dvacet larev prvního instaru se pomocí pipety bez špičky náhodně rozdělí do jednotlivých zkušebních nádob obsahujících obohacený sediment a vodu. Provzdušňování vody je nutno ukončit při přidání larev do zkušebních nádob a znovu ho zahájit nejdříve po uplynutí dalších 24 hodin po přidání larev (viz odstavce 25 a 32). Podle užitého uspořádání zkoušky (viz odstavce 19 a 20) je počet larev užitý na jednu koncentraci minimálně 60 pro odhad koncentrace vyvolávající účinek a 80 pro stanovení NOEC.
|
|
26.
|
Dvacet čtyři hodin po přidání larev se zkoušená látka vmísí do sloupce vody nad sedimentem a znovu se zavede mírné provzdušňování. Pod hladinou vody se pomocí pipety aplikují malé objemy roztoků zkoušené látky. Voda nad sedimentem se poté opatrně promíchá, aby se nerozrušil sediment.
|
Zkušební koncentrace
|
27.
|
Orientační zkouška může být užitečná pro stanovení rozsahu koncentrací pro vlastní zkoušku. K tomuto účelu jsou pakomáři exponováni řadě široce odstupňovaných koncentrací zkoušené chemické látky. S cílem zajistit stejnou hustotu povrchu na jednoho pakomára, která má být užita pro vlastní zkoušku, se pakomáři vystaví jednotlivým koncentracím zkoušené chemické látky po dobu, která umožňuje odhad vhodných zkušebních koncentrací; opakování nejsou vyžadována.
|
|
28.
|
Zkušební koncentrace pro vlastní zkoušku jsou stanoveny podle výsledku zjištění předběžné orientační zkoušky. Mělo by být vybráno a použito nejméně pět koncentrací v souladu s popisem uvedeným v odstavcích 18 až 20.
|
Kontroly
|
29.
|
Při zkoušce se použijí kontrolní nádoby bez zkoušené chemické látky, avšak obsahující sediment s příslušným počtem opakování (viz odstavce 19–20). Pokud bylo pro aplikaci zkoušené chemické látky použito rozpouštědlo (viz odstavec 16), bude přidána kontrola rozpouštědla v sedimentu.
|
Zkušební zařízení
|
30.
|
Užívají se statické systémy. Ve výjimečných případech, jako například tehdy, pokud je specifikace kvality vody nevhodná pro růst zkušebního organismu nebo ovlivňuje chemickou rovnováhu (např. přílišný pokles úrovně rozpuštěného kyslíku, přílišné zvýšení koncentrace exkrementů nebo výluh minerálů ze sedimentů, který ovlivňuje pH a/nebo tvrdost vody), lze použít semistatické nebo průtokové systémy s přerušovanou nebo kontinuální obnovou vody nad sedimentem. Zpravidla však budou postačující a vhodnější jiné metody zvýšení kvality vody nad sedimentem, jako je například provzdušňování.
|
Potrava
|
31.
|
Larvy je třeba krmit optimálně denně nebo nejméně třikrát týdně. Jako dostatečná dávka pro mladé larvy po dobu prvních 10 dnů se jeví krmivo pro ryby (suspenze ve vodě nebo jemně rozmělněné krmivo, např. Tetra-Min nebo Tetra-Phyll, viz podrobnosti v dodatku 2) v množství 0,25 až 0,5 mg (0,35 až 0,5 mg pro C. yoshimatui)) na larvu za den. Starší larvy mohou potřebovat o něco větší množství potravy: po zbývající dobu zkoušky by mělo dostačovat 0,5–1 mg na larvu denně. Pokud dojde v kontrolních skupinách k růstu plísní nebo je u nich zjištěna mortalita, je nutné přísun potravy u všech expozic snížit a kontrolovat. Pokud není možné růst plísní zastavit, je nutné zkoušku opakovat. Při testování silně adsorbujících látek (např. log Kow > 5), nebo látek s kovalentní vazbou na sediment lze dávku potravy nezbytnou pro zajištění přežití a přirozeného růstu organismů přidat do přísadami doplněného sedimentu před fází stabilizace. V takovém případě je nutno místo krmiva pro ryby použít rostlinný materiál, například přídavek 0,5 % (sušiny) jemně mletých listů např. kopřivy dvoudomé (Urtica dioica), morušovníku bílého (Morus alba), jetele plazivého (Trifolium repens), špenátu setého (Spinacia oleracea) nebo jiného rostlinného materiálu (Cerophylu nebo alfa-celulózy).
|
Inkubační podmínky
|
32.
|
Voda nad sedimentem ve zkušebních nádobách se mírně provzdušňuje v optimálním případě 24 hodin po přidání larev a je sledována po celou dobu zkoušky (je třeba dbát, aby koncentrace rozpuštěného kyslíku neklesla pod 60 % ASV). Provzdušňování se provádí pomocí skleněné Pasteurovy pipety upevněné 2–3 cm nad vrstvou sedimentu (tj. jedna nebo několik bublin/s). Při zkoušení těkavých chemických látek je možné zvolit možnost systém sediment–voda neprovzdušňovat.
|
|
33.
|
Zkouška se provádí při konstantní teplotě 20 °C (± 2 °C). Doporučená teplota pro C. tentans je 23 °C a pro C. yoshimatui 25 °C (± 2 °C). Fotoperioda je 16 hodin a intenzita světla by měla být 500 až 1 000 lux.
|
Trvání expozice
|
34.
|
Expozice je zahájena přidáním larev do obohacených a kontrolních nádob. Maximální délka trvání expozice je 28 dnů pro C. riparius a C. yoshimatsui a 65 dnů pro C. tentans. Pokud se pakomáři vylíhnou dříve, lze zkoušku ukončit po uplynutí nejméně pěti dnů od vylíhnutí posledního dospělce v kontrolní nádobě.
|
POZOROVÁNÍ
Líhnutí
|
35.
|
Určí se čas potřebný pro vývoj a celkový počet plně vylíhlých samců a samic pakomárů. Samce lze snadno rozlišit podle vějířovitých tykadel.
|
|
36.
|
Zkušební nádoby se kontrolují alespoň třikrát týdně s cílem vizuálně posoudit jakékoli neobvyklé chování (např. opouštění sedimentu, neobvyklé plavání), ve srovnání s kontrolními nádobami. Během období předpokládaného líhnutí je nutné denně počítat vylíhlé pakomáry. Pohlaví a počet plně vylíhlých pakomárů se denně zaznamenávají. Po identifikaci se pakomáři z nádob odstraní. Veškeré shluky vajíček nakladené před ukončením testu se zaznamenají a pak se odstraní, aby se zabránilo opětovnému zavlečení larev do sedimentu. Zaznamená se rovněž počet viditelných kukel, které se dosud nevylíhly. Pokyny pro měření líhnutí jsou uvedeny v dodatku 5.
|
Růst a přežívání
|
37.
|
Pokud je nutné uvést údaje o desetidenním přežití a růstu larev, je třeba na počátku zkoušky přidat další zkušební nádoby tak, aby je bylo možné následně použít. Sediment z těchto dalších nádob se proseje za použití síta o velikosti 250 μm, které udrží larvy. Kritéria uhynutí jsou nepohyblivost nebo nedostatečná reakce na mechanické podněty. Larvy, které nejsou nalezeny, by měly být rovněž považovány za uhynulé (larvy uhynulé na počátku zkoušky mohly být již rozloženy mikroby). Stanoví se váha sušiny (prosté popelovin) larev, které přežily, na zkušební nádobu a vypočte se průměrná individuální hmotnost sušiny na nádobu. Je vhodné určit, do kterého instaru přežívající larvy patří; tohoto cíle lze dosáhnout pomocí změření šířky hlavové kapsuly každého jedince.
|
Analytická měření
Koncentrace zkoušené chemické látky
|
38.
|
Musí být analyzovány minimálně vzorky vody nad sedimentem, kapilární vody a sedimentu na počátku (nejlépe hodinu po aplikaci zkoušené látky) a na konci zkoušky při nejvyšší koncentraci a jedné nižší koncentraci. Tato stanovení koncentrace zkoušené chemické látky poskytují informace o chování/distribuci zkoušené chemické látky v systému voda/sediment. Odběr vzorků sedimentu při zahájení zkoušky může ovlivnit zkušební systém (může dojít k odstranění zkušebních larev), a měly by proto být užity další zkušební nádoby k provedení analytického stanovení koncentrace na počátku zkoušky a v jejím průběhu, pokud je to vhodné (viz odstavec 39). Měření v sedimentu nemusí být nutná, pokud distribuce zkoušené látky mezi vodou a sedimentem byla jasně stanovena studií voda/sediment za srovnatelných podmínek (např. poměr sedimentu k vodě, typ aplikace, obsah organického uhlíku v sedimentu).
|
|
39.
|
Při provádění průběžných měření (např. 7. den), a v případě, že jsou pro analýzu zapotřebí rozsáhlé vzorky, které nelze ze zkušebních nádob odebrat bez dopadu na zkušební systém, je potřeba provést analytická stanovení na vzorcích z dalších zkušebních nádob, s nimiž bylo zacházeno stejným způsobem (včetně přítomnosti zkušebních organismů), ale nebyly použity pro biologická pozorování.
|
|
40.
|
Doporučeným postupem izolace intersticiální vody je odstřeďování např. při odstředivé síle 10 000 g a 4 °C po dobu 30 minut. Neadsorbuje-li se však zkoušená látka prokazatelně na filtry, je přijatelná i filtrace. V některých případech může být nemožné provést analýzu koncentrací v kapilární vodě vzhledem k tomu, že vzorek je příliš malý.
|
Fyzikálně-chemické parametry
|
41.
|
pH a rozpuštěný kyslík ve zkušební vodě a teplotu ve zkušebních nádobách je nutno měřit vhodným způsobem (viz odstavec 10). Tvrdost a obsah amoniaku by měly být měřeny v kontrolních nádobách a v jedné zkušební nádobě při nejvyšší koncentraci na počátku zkoušky a na jejím konci.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Zpracování výsledků
|
42.
|
Účelem této zkoušky je stanovit účinek zkoušené chemické látky na rychlost vývoje a celkový počet plně vylíhlých samců a samic pakomárů, nebo v případě desetidenní zkoušky účinky na přežití a hmotnost larev. Pokud nejsou k dispozici žádné údaje o statistických rozdílech citlivosti mezi oběma pohlavími, lze výsledky pro samce a pro samice sloučit pro účely statistické analýzy. Rozdíly v citlivosti mezi pohlavími lze statisticky posoudit např. pomocí χ2 – r × 2 tabulkového testu. Je-li vyžadováno stanovení přežití larev a průměru individuální sušiny na jednu nádobu, je nutné tak učinit po 10 dnech.
|
|
43.
|
Koncentrace s pozorovanými účinky vyjádřené jako koncentrace ve vodě nad sedimentem se vypočtou přednostně na základě naměřených koncentrací na počátku zkoušky (viz bod 38).
|
|
44.
|
Pro výpočet bodového odhadu EC50 nebo jakékoli jiné hodnoty ECx lze jako skutečné opakování použít statistiku na jednu nádobu. Při výpočtu intervalu spolehlivosti pro každý ECx je nutno zohlednit variabilitu mezi jednotlivými nádobami, případně prokázat, že tato variabilita je tak nízká, že ji lze ignorovat. Je-li u modelu užita metoda nejmenších čtverců, je nutné u statistik jednotlivých nádob uplatnit transformaci za účelem homogenity rozptylu. Hodnoty ECx je však třeba vypočítat až poté, co je reakce převedena zpět na původní hodnotu.
|
|
45.
|
Pokud je cílem statistické analýzy stanovení hodnoty NOEC/LOEC testováním hypotéz, je nutné vzít v úvahu variabilitu mezi nádobami, například pomocí analýzy rozptylu ANOVA. Případně mohou být vhodnější robustnější testy (21) v případě, že dojde k porušení předpokladů obvykle užitých při analýze ANOVA.
|
Procento vylíhlých jedinců
|
46.
|
Procento vylíhlých jedinců jsou kvantové údaje a lze je analyzovat s použitím postupně klesajícího Cochranova-Armitageova testu, který předpokládá monotónní odezvu na dávku, a tato data jsou konzistentní s tímto očekáváním. V opačném případě lze použít Fisherův exaktní test nebo Mantelův-Haenszelův test s Bonferroniho-Holmovou korekcí hodnot p. Pokud existují důkazy o větší variabilitě mezi replikacemi ve stejné koncentraci, pak by binomické rozdělení (často uváděné jako „extra-binomická“ variabilita) nasvědčovala tomu, že je nutno použít robustní Cochranův-Armitageův test nebo Fisherův exaktní test, jak je navrhováno v odstavci (21).
|
|
47.
|
Určí se součet pakomárů vylíhlých v jedné nádobě ne a vydělí se počtem vložených larev na:
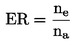
kde:
|
ER
|
=
|
procento vylíhlých jedinců,
|
|
ne
|
=
|
počet pakomárů vylíhlých v nádobě,
|
|
na
|
=
|
počet larev nasazených do nádoby.
|
|
|
48.
|
Nejvhodnější alternativou pro rozsáhlé vzorky s extra binomickou variací je pojmout procento vylíhlých jedinců jako kontinuální odezvu a použít postupy, jako je například Williamsův test, pokud existuje předpoklad monotónní odezvy na dávku a je konzistentní s těmito daty ER. V případě nemonotónní odezvy by byl vhodný Dunnettův test. Rozsáhlý vzorek je zde definován situací, při níž jak počet vylíhlých jedinců, tak počet nevylíhlých jedinců přesáhnou v jednom duplikátním vzorku (nádobě) hodnotu pět.
|
|
49.
|
Při použití metody ANOVA je nutno hodnoty ER nejprve transformovat (například druhou odmocninou arcsinu) nebo transformací podle Freemana-Tukeyho s cílem získat přibližné normální rozdělení údajů a vyrovnat odchylky. Při použití absolutních frekvencí lze použít test dle Cochrana-Armitage, Fisherův exaktní test (s Bonferroniho korekcí) nebo Mantelův-Haenszelův test. Transformace funkcí rovnou √arcsin se vypočte pomocí převrácené hodnoty sinu (sin–1) z odmocniny ER.
|
|
50.
|
Pro procento vylíhlých jedinců se hodnoty ECx vypočtou pomocí regresní analýzy (nebo např. pomocí modelu probit, (22), logit, Weibull, vhodného komerčního softwaru atd.). V případě selhání regresní analýzy (např. v případě méně než dvou koncentrací s parciálními odezvami) se použijí další neparametrické metody, jako je například klouzavý průměr nebo prostá interpolace.
|
Rychlost vývoje
|
51.
|
Průměrná doba vývoje představuje průměrné časové rozpětí mezi nasazením larev (den 0 zkoušky) a vylíhnutím experimentální kohorty pakomárů. (Pro výpočet skutečné doby vývoje by mělo být zohledněno stáří larev v okamžiku nasazení. Rychlost vývoje je převrácenou hodnotou doby vývoje (jednotka: 1/den) a představuje část larválního vývoje, která se odehraje za den. Rychlost vývoje je z hlediska hodnocení těchto studií toxicity sedimentů preferována před dobou vývoje vzhledem k její nižší variabilitě, vyšší homogenitě a větší blízkosti normálnímu rozdělení. Z tohoto důvodu mohou být použity silné parametrické zkušební postupy pro rychlost vývoje, a ne pro dobu vývoje. Pro rychlost vývoje jako kontinuální odezvu lze hodnoty ECx stanovit odhadem pomocí regresní analýzy (např. (23), (24).)
|
|
52.
|
U následujících statistických testů se má za to, že počet pakomárů pozorovaných v inspekčním dni x se vylíhl v průměru časového intervalu mezi dnem x a dnem x – l (l = délka intervalu mezi pozorováními, obvykle 1 den). Průměrná rychlost vývoje na nádobu (x) se vypočte podle vzorce:
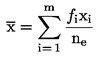
kde:
|
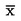
|
:
|
střední rychlost vývoje v kádince,
|
|
i
|
:
|
index intervalu mezi pozorováními,
|
|
m
|
:
|
maximální počet všech intervalů mezi pozorováními,
|
|
|
:
|
počet vylíhlých jedinců během daného intervalu mezi pozorováními i,
|
|
ne
|
:
|
celkový počet vylíhlých jedinců celkem na konci pokusu ( ) )
|
|
xi
|
:
|
rychlost vývoje pakomárů vylíhlých v intervalu i,
|
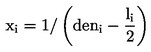
kde:
|
deni
|
:
|
den pozorování (ve dnech od aplikace),
|
|
li
|
:
|
délka intervalu i mezi pozorováními (ve dnech, obvykle 1 den).
|
|
Protokol o zkoušce
|
53.
|
Protokol o zkoušce musí obsahovat minimálně tyto údaje:
|
|
Zkoušená látka:
|
—
|
fyzikální povahu a případně fyzikálně-chemické vlastnosti (rozpustnost ve vodě, tlak par, rozdělovací koeficient v půdě (případně v sedimentu), stabilita ve vodě, atd.),
|
|
—
|
chemické identifikační údaje (obecný název, chemický název, strukturní vzorec, číslo CAS atd.) včetně čistoty a analytické metody pro kvantitativní stanovení zkoušené látky.
|
|
|
|
Testovací druh:
|
—
|
užitá pokusná zvířata: druh, vědecký název, zdroj organismů a podmínky množení,
|
|
—
|
informace o nakládání se shluky vajíček a s larvami,
|
|
—
|
stáří testovaných zvířat po nasazení do zkušebních nádob.
|
|
|
|
Zkušební podmínky:
|
—
|
použitý sediment, tj. přírodní nebo přísadami doplněný sediment,
|
|
—
|
u přírodního sedimentu lokalita a popis místa odběru sedimentu, pokud možno včetně dřívější kontaminace, charakteristiky: pH, obsah organického uhlíku, poměr C/N a zrnitost (je-li to vhodné),
|
|
—
|
příprava přísadami doplněného sedimentu: složky a charakteristiky (obsah organického uhlíku, pH, vlhkost, atd. na začátku zkoušky),
|
|
—
|
příprava zkušební vody (pokud se používá rekonstituovaná voda) a její charakteristiky (koncentrace kyslíku, pH, vodivost, tvrdost, atd. na začátku zkoušky),
|
|
—
|
hloubka sedimentu a vody nad sedimentem,
|
|
—
|
objem vody nad sedimentem a kapilární vody, hmotnost vlhkého sedimentu s kapilární vodou a bez ní,
|
|
—
|
zkušební nádoby (materiál a rozměry),
|
|
—
|
metoda přípravy zásobních roztoků a zkušební koncentrace,
|
|
—
|
aplikace zkoušené látky, použité zkušební koncentrace, počet duplikátních vzorků a případné použití rozpouštědla,
|
|
—
|
inkubační podmínky: teplota, cyklus a intenzita světla, provzdušňování (frekvence a intenzita),
|
|
—
|
podrobné informace o krmení včetně typu krmiva, přípravy, množství a režimu krmení.
|
|
|
|
Výsledky:
|
—
|
nominální zkušební koncentrace, naměřené zkušební koncentrace a výsledky všech analýz pro stanovení koncentrace zkoušené chemické látky ve zkušební nádobě,
|
|
—
|
kvalita vody ve zkušebních nádobách, tj. pH, teplota, rozpuštěný kyslík, tvrdost a amoniak,
|
|
—
|
případné nahrazování odpařené zkušební vody,
|
|
—
|
počet vylíhlých samců a samic pakomárů na nádobu a na den,
|
|
—
|
počet larev, z nichž se nevylíhli dospělci, na nádobu,
|
|
—
|
průměrná individuální hmotnost sušiny larev na nádobu a případně na instar,
|
|
—
|
procento vylíhlých jedinců na duplikátní vzorek a zkušební koncentraci (směsný vzorek samců a samic pakomárů),
|
|
—
|
průměrná rychlost vývoje plně vylíhlých pakomárů na duplikátní vzorek a aplikované množství (směsný vzorek samců a samic pakomárů),
|
|
—
|
odhady koncových bodů toxicity, např. ECx (a související intervaly spolehlivosti), NOEC a/nebo LOEC a statistické metody použité k jejich stanovení,
|
|
—
|
diskuse o výsledcích včetně případného vlivu na výsledek zkoušky v důsledku odchylek od této zkušební metody.
|
|
|
LITERATURA:
|
1)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke and H. Köpp. Berlin 1995.
|
|
2)
|
Fleming R et al. (1994). Sediment Toxicity Tests for Poorly Water-Soluble Substances. Final Report to them European Commission. Report No: EC 3738. August 1994. WRc, UK.
|
|
3)
|
SETAC (1993). Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments. From the WOSTA Workshop held in the Netherlands.
|
|
4)
|
ASTM International/E1706-00 (2002). Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates. pp 1125-1241. In ASTM International 2002 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
5)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
6)
|
US-EPA (2000). Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates. Second edition. EPA 600/R-99/064. March 2000. Revision to the first edition dated June 1994.
|
|
7)
|
US-EPA/OPPTS 850.1735. (1996): Whole Sediment Acute Toxicity Invertebrates.
|
|
8)
|
US-EPA/OPPTS 850.1790. (1996): Chironomid Sediment toxicity Test.
|
|
9)
|
Milani D, Day KE, McLeay DJ, Kirby RS (1996). Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada’s biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius). Technical Report. Environment Canada. National Water Research Institute. Burlington, Ontario, Canada.
|
|
10)
|
Sugaya Y (1997). Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui. Jp. J. Sanit. Zool. 48 (4): 345–350.
|
|
11)
|
Kawai K (1986). Fundamental studies on Chironomid allergy. I. Culture methods of some Japanese Chironomids (Chironomidae, Diptera). Jp. J. Sanit. Zool. 37(1): 47–57.
|
|
12)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
13)
|
Environment Canada (1995). Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant. Report EPS 1/RM/30. September 1995.
|
|
14)
|
Kapitola C.8 této přílohy, Toxicita pro žížaly,
|
|
15)
|
Suedel BC and Rodgers JH (1994). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13: 1163–1175.
|
|
16)
|
Naylor C and Rodrigues C (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291–3303.
|
|
17)
|
Dunnett CW (1964). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc. 50: 1096–1121.
|
|
18)
|
Dunnett CW (1964). New tables for multiple comparisons with a control. Biometrics 20: 482–491.
|
|
19)
|
Williams DA (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103–117.
|
|
20)
|
Williams DA (1972). The comparison of several dose levels with a zero dose control. Biometrics 28: 510–531.
|
|
21)
|
Rao JNK and Scott AJ (1992). A simple method for the analysis of clustered binary data. Biometrics 48:577–585.
|
|
22)
|
Christensen ER (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18: 213–221.
|
|
23)
|
Bruce and Versteeg (1992). A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485–1494.
|
|
24)
|
Slob W (2002). Dose-response modelling of continuous endpoints. Toxicol. Sci. 66: 298–312.
|
Dodatek 1
DEFINICE
Pro účely této metody se použijí tyto definice:
|
|
Přísadami doplněný sediment nebo rekonstituovaný, umělý nebo syntetický sediment je směs materiálů užitá k napodobení fyzických složek přírodního sedimentu.
|
|
|
Voda nad sedimentem je voda nacházející se nad sedimentem ve zkušební nádobě.
|
|
|
Intersticiální voda nebo kapilární voda je voda zabírající prostor mezi sedimentem a částicemi půdy.
|
|
|
Obohacená voda je zkušební voda, do níž byla přidána zkoušená látka.
|
|
|
Zkoušená chemická látka: jakákoli látka nebo směs testovaná pomocí této zkušební metody.
|
Dodatek 2
Doporučení pro kultivaci kultury Chironomus riparius
|
1.
|
Larvy rodu Chironomus lze chovat v krystalizačních miskách nebo ve větších nádobách. Jemný křemičitý písek se rozprostře po dně nádoby v tenké vrstvě silné 5 až 10 mm. Bylo prokázáno, že substrátem vhodným jako podklad je také křemelina (např. Merck, čl. 8117), (dostačující je tenčí vrstva silná jen několik málo mm). Následně se přidá několikacentimetrová vrstva vhodné vody. Objem vody by se měl podle potřeby doplňovat s cílem nahradit ztráty vzniklé odpařováním a zabránit vysychání. Vodu lze v případě potřeby vyměnit. Je třeba zajistit mírné provzdušňování. Nádoby, v nichž jsou larvy chovány, by měly být umístěny ve vhodné kleci, která zabrání úniku líhnoucích se dospělců. Tato klec by měla být dostatečně velká, aby umožňovala rojení vylíhlých dospělců, jinak by nemuselo dojít k jejich páření (minimum je přibližně 30×30×30 cm).
|
|
2.
|
Klece by měly být umístěny při pokojové teplotě nebo v místnosti s konstantní teplotou 20 ± 2 °C s fotoperiodou 16 hodin světlo (intenzity přibližně 1 000 lux) a 8 hodin tma. Bylo zjištěno, že vzdušná vlhkost nižší než 60 % RH může bránit rozmnožování.
|
Ředicí voda
|
3.
|
Lze použít jakoukoli vhodnou přírodní nebo syntetickou vodu. Zpravidla se užívá studniční voda, odchlorovaná vodovodní voda a umělá média (např. Elendtovo médium „M4“ nebo „M7“, viz níže). Vodu je před použitím nutno provzdušnit. Je-li to nutné, lze kultivační vodu obnovit opatrným odlitím nebo odčerpáním použité vody z kultivačních nádob tak, aby nedošlo k poškození schránek larev.
|
Krmení larev
|
4.
|
Larvy rodu Chironomus by se měly krmit vločkovým krmivem pro ryby (TetraMin(®, Tetra Phyll® nebo jiná podobná značka patentovaného krmiva pro ryby), v množství přibližně 250 mg na nádobu a den. Potravu lze aplikovat v podobě suchého mletého prášku nebo v podobě suspenze ve vodě: 1,0 g vločkového krmiva se přidá do 20 ml ředicí vody a vytvoří se homogenní směs. Tento přípravek lze dodávat rychlostí přibližně 5 ml na nádobu na den (před použitím protřepat). Starším larvám lze přidat více krmiva.
|
|
5.
|
Krmení se upraví podle kvality vody. V případě, že se kultivační médium „zakalí“, je třeba krmnou dávku snížit. Přidávání potravy je nutno pečlivě sledovat. Příliš malé množství krmiva způsobí, že larvy opouštějí sediment a vznášejí se ve vodním sloupci, a příliš mnoho krmiva způsobí zvýšenou mikrobiální činnost a pokles koncentrace kyslíku. Obojí může způsobit snížení rychlosti růstu.
|
|
6.
|
Do nových kultivačních nádob mohou být přidány i buňky zelených řas (např. Scenedesmus subspicatus, Chlorella vulgaris).
|
Krmení vylíhlých dospělců
|
7.
|
Někteří experimentátoři se domnívají, že jako potrava vylíhlých dospělců může sloužit vata namočená do nasyceného roztoku sacharózy.
|
Líhnutí
|
8.
|
Dospělci se začnou v chovných nádobách líhnout při teplotě 20 ± 2 °C přibližně po 13–15 dnech. Samce lze snadno rozlišit podle vějířovitých tykadel.
|
Shluky vajíček
|
9.
|
Jakmile se ve snubní komůrce nacházejí dospělci, je třeba třikrát týdně kontrolovat všechny reprodukční nádoby, zda se v nich nacházejí shluky vajíček spojené želatinózní hmotou. Pokud se zde shluky vajíček nacházejí, je nutno je opatrně odstranit a přemístit do malé misky obsahující vzorek chovného vodního prostředí. Shluky vajíček se užijí pro založení nové nádoby s kulturou (např. 2–4 shluky vajíček na nádobu) nebo se užijí pro zkoušky toxicity.
|
|
10.
|
Larvy prvního instarového stadia by se měly vylíhnout za 2–3 dny.
|
Zakládání nových kultivačních nádob
|
11.
|
Jakmile jsou kultury založeny, mělo by být možné zakládat nové nádoby s kulturami larev jednou týdně nebo méně často v závislosti na zkušebních požadavcích a odstraňovat starší nádoby po vylíhnutí dospělců. Pomocí tohoto systému se zajistí pravidelné dodávky dospělců s minimální potřebou dohledu.
|
Příprava zkušebních roztoků „M4“ a „M7“
|
12.
|
Elendt (1990) popsal médium „M4“. Médium „M7“ se připraví obdobně jako médium „M4“ s výjimkou látek uvedených v tabulce 1, u nichž jsou koncentrace u „M7“ čtyřikrát nižší než u „M4“. Připravuje se publikace o médiu „M7“ (Elendt, osobní sdělení). Podle Elendta a Biase (1990) by se zkušební roztok neměl připravovat pro koncentrace NaSiO3 5 H2O, NaNO3, KH2PO4 a K2HPO4 vzhledem k tomu, že nejsou pro přípravu zásobních roztoků vyhovující.
|
Příprava média „M7“
|
13.
|
Každý zásobní roztok (I) se připraví samostatně a z těchto zásobních roztoků (I) se pak připraví kombinovaný zásobní roztok (II) (viz tabulka 1). Médium „M7“ se připraví přidáním 50 ml kombinovaného zásobního roztoku (II) a množství zásobního roztoku jednotlivých makroživin, které jsou uvedeny v tabulce 2, do 1 litru deionizované vody. Připraví se vitaminový zásobní roztok přidáním tří vitaminů do deionizované vody, jak je uvedeno v tabulce 3, a 0,1 ml kombinovaného vitaminového zásobního roztoku se přidá do výsledného média „M7“ krátce před použitím. (Vitaminový zásobní roztok se uskladňuje zmrazený v malých alikvotních dílech.) Médium se provzdušní a stabilizuje.
Tabulka 1
Zásobní roztoky stopových prvků pro médium M4 a M7
|
Zásobní roztoky (I)
|
Množství (mg) doplněné na 1 litr deionizované vody
|
Kombinovaný zásobní roztok (II) se připraví smícháním následujících množství (v ml) zásobních roztoků (I) a doplněním na 1 litr deionizované vody
|
Konečné koncentrace ve zkušebním roztoku (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(18)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4 H2O (18)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (18)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (18)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6 H2O (18)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (18)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2 H2O (18)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2 H2O (18)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6 H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2 H2O (18)
(19)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7 H2O (18)
(19)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tabulka 2
Zásobní roztoky makroživin pro médium M4 a M7
|
|
Množství doplněné na 1 litr deionizované vody
(mg)
|
Množství zásobních roztoků makroživin přidané za účelem přípravy média M4 a M7
(ml/l)
|
Konečné koncentrace ve zkušebním roztoku M4 a M7
(mg/l)
|
|
CaCl2 · 2 H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7 H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9 H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tabulka 3
Vitaminový zásobní roztok pro médium M4 a M7
Všechny tři vitaminové roztoky se smísí do jediného vitaminového zásobního roztoku.
|
|
Množství doplněné na 1 litr deionizované vody
(mg)
|
Množství vitaminového zásobního roztoku přidané za účelem přípravy média M4 a M7
(ml/l)
|
Konečné koncentrace ve zkušebním roztoku M4 a M7
(mg/l)
|
|
Thiaminhydrochlorid
|
750
|
0,1
|
0,075
|
|
Kyanokobalamin (B12)
|
10
|
0,1
|
0,0010
|
|
Biotin
|
7,5
|
0,1
|
0,00075
|
|
LITERATURA:
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke and H.Köpp. Berlin 1995.
Elendt BP (1990). Selenium Deficiency in Crustacean. Protoplasma 154: 25-33.
Elendt BP and Bias W-R (1990). Trace Nutrient Deficiency in Daphnia magna Cultured in Standard Medium for Toxicity Testing. Effects on the Optimization of Culture Conditions on Life History Parameters of D. magna. Water Research 24 (9): 1157-1167.
Dodatek 3
PŘÍPRAVA PŘÍSADAMI DOPLNĚNÉHO SEDIMENTU
Složení sedimentu
Složení přísadami doplněného sedimentu by mělo být následující:
|
Složka
|
Charakteristika
|
% sušiny
sedimentu
|
|
Rašelina:
|
rašelina mechu Sphagnum s pH co nejblíže 5,5 až 6,0, bez viditelných zbytků rostlin a jemně mletá (velikost částic ≤ 1 mm) a vysušená na vzduchu
|
4–5
|
|
Křemičitý písek
|
velikost zrn: > 50 % částic musí být v rozpětí 50–200 μm
|
75–76
|
|
Kaolinitický jíl
|
obsah kaolinitu≥ 30 %
|
20
|
|
Organický uhlík
|
upraven přidáním rašeliny a písku
|
2 (± 0,5)
|
|
Uhličitan vápenatý
|
CaCO3, práškový, chemicky čistý
|
0,05–0,1
|
|
Voda
|
vodivost ≤ 10 μS/cm
|
30–50
|
Příprava
Rašelina se usuší na vzduchu a rozemele se na jemný prášek. Připraví se suspenze požadovaného množství rašelinného prášku v deionizované vodě s použitím vysoce výkonného homogenizačního zařízení. pH této suspenze se upraví na 5,5 ± 0,5 pomocí CaCO3. Suspenze se kondicionuje po dobu nejméně dvou dní za mírného promíchávání při 20 ± 2 °C za účelem stabilizace pH a vytvoření stabilní mikrobiální složky. Poté se opět změří pH, které by se mělo rovnat 6,0 ± 0,5. Pak se suspenze rašeliny smísí s ostatními složkami (písek a kaolín) a s deionizovanou vodou s cílem získat homogenní sediment s obsahem vody v rozmezí 30–50 procent sušiny sedimentu. Znovu se změří pH konečné směsi a v případě nutnosti je opět upraveno pomocí CaCO3 na hodnotu 6,5 až 7,5. Odeberou se vzorky sedimentu pro stanovení obsahu sušiny a obsahu organického uhlíku. Následně se doporučuje před použitím pro zkoušku toxicity pro pakomáry přísadami doplněný sediment kondicionovat po dobu sedmi dnů za stejných podmínek, které převládají v následné zkoušce.
Skladování
Suché složky pro přípravu umělého sedimentu lze skladovat na suchém a chladném místě při pokojové teplotě. Přísadami doplněný (mokrý) sediment by neměl být před použitím ve zkoušce skladován. Měl by být použit ihned po uplynutí sedmidenního období kondicionování, kterým končí jeho příprava.
LITERATURA:
Kapitola C.8 této přílohy. Toxicita pro žížaly.
Meller M, Egeler P, Rombke J, Schallnass H, Nagel R, Streit B (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulfate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety 39: 10–20.
Dodatek 4
Chemické charakteristiky přípustné ředicí vody
|
Látka
|
Koncentrace
|
|
Částice tuhé
|
< 20 mg/l
|
|
Celkový obsah organického uhlíku
|
< 2 mg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Tvrdost jako CaCO3
|
< 400 mg/l (20)
|
|
Zbytkový chlor
|
< 10 μg/l
|
|
Celkové organické fosforové pesticidy
|
< 50 ng/l
|
|
Celkové organické chlorové pesticidy a polychlorované bifenyly
|
< 50 ng/l
|
|
Celkový organický chlor
|
< 25 ng/l
|
Dodatek 5
Pokyny pro monitorování líhnutí larev pakomárů
Na zkušební kádinky jsou umístěny výletové pasti. Tyto pasti jsou potřebné od 20. dne až do konce zkoušky. Níže je nakreslen příklad používané pasti:
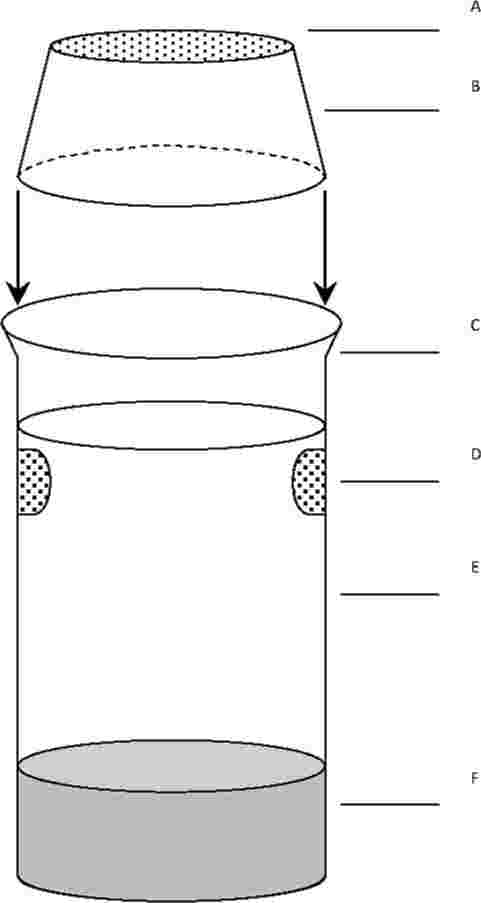
|
A
|
:
|
nylonová síťka
|
|
B
|
:
|
plastový kryt
|
|
C
|
:
|
kádinka bez zobáčku
|
|
D
|
:
|
otvory na výměnu vody
|
|
E
|
:
|
voda
|
|
F
|
:
|
sediment
|
C.29 HODNOCENÍ SNADNÉ BIOLOGICKÉ ROZLOŽITELNOSTI – UVOLŇOVÁNÍ CO2 V TĚSNĚ UZAVŘENÝCH LAHVIČKÁCH (HEADSPACE TEST)
ÚVOD
|
1.
|
Tato zkušební metoda odpovídá pokynu OECD pro zkoušení (TG) 310 (2006). Tato zkušební metoda je screeningovou metodou pro hodnocení snadné biologické rozložitelnosti chemických látek a poskytuje obdobné informace jako šest zkušebních metod popsaných v kapitole C.4 této přílohy A až F. Proto lze chemickou látku, která v této zkušební metodě vykazuje pozitivní výsledky, považovat za snadno biologicky rozložitelnou a v důsledku toho rychle rozložitelnou v prostředí.
|
|
2.
|
Dobře vyzkoušená metoda uvolňování oxidu uhličitého (CO2) (1), která je založena na původní Sturmově zkoušce (2) hodnocení biologické rozložitelnosti organických chemických látek měřením emisí oxidu uhličitého produkovaného mikrobiální činností, je zpravidla první možností testování špatně rozpustných a silně absorbujících chemických látek. Je užívána rovněž v případě rozpustných (avšak nikoli těkavých) látek, protože uvolňování oxidu uhličitého řada odborníků považuje za jediný nepochybný důkaz mikrobiální aktivity. Odstranění rozpuštěného organického uhlíku se může uskutečnit fyzikálně-chemickými procesy – adsorpcí, vypařováním, srážením, hydrolýzou, ale je spotřebováván i mikrobiální činností a při řadě nebiologických reakcí; jen vzácně vzniká CO2 z organických sloučenin abioticky. V původní a modifikované Sturmově zkoušce (1, 2) se odstraní CO2 z kapalné fáze do absorpčních nádob probubláváním (tj. bublající vzduch upravený na odstraňování CO2 prostřednictvím kapalného prostředí), zatímco v Larsonově verzi (3, 4) se CO2 přenáší z reakční nádoby do absorbérů proháněním vzduchu bez CO2 přes plynnou fázi, a navíc neustálým třepáním zkušební nádobou. Pouze v Larsonově modifikaci se reakční nádobou třepe; míchání je určeno pouze pro nerozpustné látky podle normy ISO 9439 (5) a v originální americké verzi (6), které obě uvádějí probublávání, a nikoli nahrazování plynné fáze. V jiné oficiální metodě US EPA (7) založené na Gledhillově metodě (8) se třesená reakční nádoba uzavře před atmosférou a vytvořený CO2 se shromažďuje ve vnitřním zásaditém zařízení pro zachycování přímo z plynné fáze, stejně jako v klasických Warburg/Barcroftových respirometrických baňkách.
|
|
3.
|
U anorganického uhlíku (IC) však bylo prokázáno, že se při použití standardní modifikované Sturmovy zkoušky u řady chemických látek hromadí v médiu (9). Při rozkladu 20 mg C/l anilinu byla zjištěna koncentrace IC až 8 mg/l. To znamená, že zachycování CO2 v zásaditém zařízení pro zachycování neposkytovalo věrný obraz o množství CO2 vyprodukovaného mikrobiologicky v mezičasech během rozkladu. V důsledku této skutečnosti nebude specifikace, že > 60 % teoretické maximální produkce CO2 (TCO2) se musí shromáždit v průběhu „10denního období rozkladu“ (10 dnů, které následují bezprostředně po dosažení 10 % rozkladu), aby bylo možno zkoušenou chemickou látku klasifikovat jako snadno biologicky rozložitelnou, dodržena u některých chemických látek, které by byly takto klasifikovány pomocí odstranění rozpuštěného organického uhlíku (DOC).
|
|
4.
|
Když má procento rozkladu nižší než předpokládanou hodnotu, je možné, že dochází k hromadění IC ve zkušebním roztoku. V takovém případě lze rozložitelnost odhadnout pomocí ostatních zkoušek snadné biologické rozložitelnosti.
|
|
5.
|
Další nedostatky Sturmovy metodiky (těžkopádná, časově náročná, náchylnější k experimentálním chybám a nepoužitelná pro těkavé chemické látky) již dříve podnítily snahu hledat jinou než Gledhillovu techniku využívající těsně uzavřené nádoby, která by nebyla založena na průtoku plynu. (10, 11). Boatman a spolupracovníci (12) přezkoumali již existující metody a přijali metodu systému těsně uzavřených lahviček, v nichž se CO2 uvolňuje do plynné fáze na konci inkubace po okyselení média. Obsah CO2 byl měřen pomocí plynové chromatografie (analýza GC)/IC) ve vzorcích automaticky odebíraných z plynné fáze, avšak nebyl zohledněn rozpuštěný anorganický uhlík (DIC) v kapalné fázi. Rovněž použité nádobky byly velmi malé (20 ml) a obsahovaly pouze 10 ml média, což bylo příčinou problémů, např. při přidávání množství nerozpustných zkoušených chemických látek, které nutně muselo být jen velmi malé, případně vzhledem k přítomnosti nedostatečného nebo nulového množství mikroorganismů schopných rozložit zkoušené chemické látky v inokulovaném médiu.
|
|
6.
|
Tyto obtíže překonaly nezávislé studie Struijse a Stoltenkampa (13) a Birche a Fletchera (14), přičemž poslední z uvedených byli inspirováni svými zkušenostmi se zařízením používaným při zkoušce anaerobního biologického rozkladu (15). Při užití původní metody (13) se měří CO2 v plynné fázi po okyselení a ustavení rovnováhy, zatímco ve druhém případě (14) se měřil DIC v plynné i v kapalné fázi bez expozice; přes 90 % vytvořeného IC se nacházelo v kapalné fázi. Obě metody mají oproti Sturmově zkoušce výhodu v tom, že zkušební systém byl kompaktnější a lépe ovladatelný, lze v něm zkoušet těkavé chemické látky a lze se vyhnout zpoždění při měření vyprodukovaného CO2.
|
|
7.
|
Oba tyto přístupy byly spojeny v normě ISO upravující CO2„headspace“ metodu (16), která byla zkoušena v mezilaboratorních porovnávacích zkouškách (17), a tato norma tvoří základ této zkušební metody. Oba uvedené přístupy byly použity rovněž v metodě US EPA (18). Jsou doporučovány dvě metody měření CO2, a to měření CO2 v plynné fázi po okyselení (13) a IC v kapalné fázi po přídavku nadbytku zásady. Druhou metodu zavedl Peterson při mezilaboratorní porovnávací zkoušce CONCAWE (19) této headspace metody upravené tak, aby měřila vlastní biologickou rozložitelnost. Do této zkušební metody byly začleněny změny provedené při přepracování těchto metod z roku 1992 (20) v kapitole C.4 této přílohy o snadné biologické rozložitelnosti, takže podmínky (médium, trvání apod.) jsou jinak stejné jako podmínky v přepracované Sturmově zkoušce (20). Birch a Fletcher (14) ukázali, že pomocí této headspace zkoušky byly získány velmi podobné výsledky jako u stejných chemických látek v mezilaboratorní porovnávací zkoušce přepracovaných zkušebních metod OECD (21).
|
PODSTATA ZKOUŠKY
|
8.
|
Zkoušená látka se zpravidla v koncentraci 20 mg C/l jako jediný zdroj uhlíku a energie inkubuje v pufru – médiu vytvořeném z minerálních solí, které je inokulováno směsnou kulturou mikroorganismů. Zkouška se provádí v těsně uzavřených nádobách s určitým volným objemem vzduchu pod víčkem, který představuje rezervoár kyslíku pro aerobní biologický rozklad. Uvolňování CO2 v důsledku úplného aerobního biologického rozkladu zkoušené chemické látky se stanoví měřením produkce IC ve zkušebních nádobách, která je větší než produkce slepým stanovením u nádob obsahujících pouze inokulované médium. Stupeň biologického rozkladu se vyjadřuje v procentech teoretické maximální produkce anorganického uhlíku (ThIC), vztažené k množství zkoušené chemické látky (jako je například organický uhlík) přidané na začátku zkoušky.
|
|
9.
|
U zkoušených látek lze stanovit také úbytek DOC a/nebo rozsah primárního biologického rozkladu nebo zkoušené chemické látky (20).
|
INFORMACE O ZKOUŠENÉ LÁTCE
|
10.
|
Pro výpočet procenta rozkladu musí být znám obsah organického uhlíku (% w/w) ve zkoušené chemické látce, a to buď na základě její chemické struktury, nebo na základě měření. U těkavých zkoušených látek je pro stanovení vhodného poměru mezi plynnou a kapalnou fází vhodné použít změřenou nebo vypočítanou Henryho konstantu. Informace o toxicitě zkoušené látky pro mikroorganismy jsou užitečné při výběru vhodné zkušební koncentrace a při interpretaci výsledků, které ukazují na špatnou biologickou rozložitelnost; doporučuje se zahrnout kontrolu inhibice s výjimkou případů, kdy je známo, že zkoušená látka nepůsobí inhibičně na mikrobiální aktivity (viz odstavec 24).
|
VHODNOST ZKUŠEBNÍ METODY
|
11.
|
Zkoušku lze použít pro zkoušené chemické látky, které jsou rozpustné ve vodě, i pro nerozpustné zkoušené chemické látky, avšak je nezbytné, aby se zkoušená chemická látka dobře rozptýlila. Při použití doporučeného poměru 1:2 mezi plynnou a kapalnou fází lze zkoušet těkavé chemické látky s Henryho konstantou do 50 Pa.m3.mol–1 vzhledem k tomu, že podíl zkoušené chemické látky v plynné fázi nepřesáhne 1 % (13). Při zkoušení chemických látek, které jsou méně stálé, lze použít menší objem plynné fáze, avšak jejich biologická dostupnost může být omezující, zejména v případě, že jsou špatně rozpustné ve vodě. Uživatelé však musí zajistit, aby poměr mezi plynnou a kapalnou fází a koncentrace zkoušené chemické látky byly takové, aby zajišťovaly dostatečnou koncentraci kyslíku v plynné fázi pro úplný aerobní biologický rozklad (např. je nutné se vyvarovat použití vysokých koncentrací substrátu a malého objemu plynné fáze). Pokyny týkající se této problematiky lze nalézt v bodech (13, 23).
|
REFERENČNÍ CHEMICKÉ LÁTKY
|
12.
|
Za účelem kontroly zkušebního postupu by měla být současně zkoušena referenční látka známé biologické rozložitelnosti. Za tímto účelem lze použít anilin, benzoát sodný nebo ethylenglykol pro zkoušení chemických látek rozpustných ve vodě a oktan-1-ol pro špatně rozpustné zkoušené chemické látky (13). Biologický rozklad těchto látek musí do 14 dnů dosáhnout > 60 % ThIC.
|
REPRODUKOVATELNOST
|
13.
|
V mezilaboratorní porovnávací zkoušce této metody dle ISO (17), byly při dodržení doporučených podmínek včetně koncentrace zkoušené chemické látky 20 mg C/l dosaženy tyto výsledky:
|
Zkoušená chemická látka
|
Průměrné procento biologického rozkladu
(28 d)
|
Variační koeficient
(%)
|
Počet laboratoří
|
|
Anilin
|
90
|
16
|
17
|
|
Oktan-1-ol
|
85
|
12
|
14
|
Mezilaboratorní variabilita (reprodukovatelnost) byla u anilinu nízká, přičemž variační koeficient téměř u všech zkoušek nepřesáhl 5 %. V obou případech, kdy byla reprodukovatelnost nižší, byla vyšší variabilita pravděpodobně důsledkem vysoké produkce IC u slepého stanovení. Reprodukovatelnost u oktan-1-olu byla nižší, přesto však byla u 79 % zkoušek nižší než 10 %. Tato větší variabilita v rámci zkoušek může být způsobena chybami v dávkování vzhledem k tomu, že do pevně uzavřených zkušebních lahviček je nutno vstříknout malý objem (3–4 μl) oktan-1-olu. Vyšších variačních koeficientů by bylo dosaženo při použití nižších koncentrací zkoušené chemické látky, a to zejména v koncentracích nižších než 10 mg C/l. Tomu by bylo možné částečně předejít snížením koncentrace celkového anorganického uhlíku (TIC) v inokulu.
|
|
14.
|
V mezilaboratorní porovnávací zkoušce EU (24) byly z pěti povrchově aktivních látek přidaných na 10 mg C/l získány tyto výsledky:
|
Zkoušená chemická látka
|
Průměrné procento biologického rozkladu
(28 d)
|
Variační koeficient
(%)
|
Počet laboratoří
|
|
Tetrapropylen
Benzensulfonát
|
17
|
45
|
10
|
|
Di-iso-oktylsulfo-sukcinát
(aniontový)
|
72
|
22
|
9
|
|
Hexadecyl-trimethyl (21)
Chlorid amonný
(kationtový)
|
75
|
13
|
10
|
|
Iso-nonylfenol -(ethoxylát)9
(neiontový)
|
41
|
32
|
10
|
|
Kokamidopropyl
Dimethylhydroxy
sulfobetain
(amfoterní)
|
60
|
23
|
11
|
Výsledky ukazují, že obecně platí, že variabilita byla vyšší u hůře rozložených povrchově aktivních látek. Variabilita v rámci zkoušky byla u více než 90 % případů nižší než 15 %, přičemž nejvyšší dosáhla 30–40 %.
|
POZNÁMKA:
|
Většina povrchově aktivních látek nejsou jednotlivé molekuly, ale jedná se o směsi izomerů, homology atd., které se rozkládají po různých charakteristických lagových fázích a podle různých kinetických rychlostních konstant vedoucích k „rozostření“ zeslabených křivek, takže 60 % hodnoty „vyhověla“ nelze dosáhnout v rámci „10denního období rozkladu“, i kdyby každá jednotlivá molekula dosáhla hodnoty > 60 % během 10 dnů, pokud by byla testována samostatně. Obdobně je tomu při použití jiných komplexních směsí.
|
|
POPIS METODY
Přístroje a pomůcky
|
15.
|
Obvyklé laboratorní vybavení a dále:
|
a)
|
skleněné lahvičky na sérum, těsně uzavřené pryžovým septem z butylkaučuku s hliníkovými lemovacími uzávěry. Doporučená velikost je „125 ml“, která má celkový objem asi 160 ml (v tomto případě by mělo být známo, že objem každé láhve je 160 ± 1 ml). Menší nádobu lze použít tehdy, pokud výsledky splňují podmínky uvedené v odstavcích 66 a 67;
|
|
b)
|
analyzátor uhlíku nebo jiný přístroj (například plynový chromatograf) ke stanovení anorganického uhlíku;
|
|
c)
|
stříkačky s vysokou přesností pro plynné a vodné vzorky;
|
|
d)
|
orbitální třepačka v termostatovaném prostředí;
|
|
e)
|
zásoba vzduchu bez CO2 – lze ji připravit proháněním vzduchu přes granule natronového vápna nebo použitím plynné směsi 80 % N2 a 20 % O2 (nepovinné) (viz odstavec 28);
|
|
f)
|
zařízení pro filtraci s membránovými filtry porozity 0,20 až 0,45 μm (nepovinné);
|
|
g)
|
analyzátor organického uhlíku (nepovinné).
|
|
Činidla
|
16.
|
Používají se pouze chemikálie zaručené analytické jakosti.
|
Voda
|
17.
|
Měla by se používat destilovaná nebo deionizovaná voda s celkovým obsahem organického uhlíku ≤ 1 mg/l. To představuje ≤ 5 % z počáteční hodnoty organického uhlíku vneseného doporučenou dávkou zkoušené chemické látky.
|
Zásobní roztoky pro médium s minerálními solemi
|
18.
|
Zásobní roztoky a médium s minerálními solemi jsou obdobné jako u zkoušek „snadné biologické rozložitelnosti“ podle ISO 14593 (16) a C.4 (20). Použití vyšší koncentrace chloridu amonného (2,0 g/l místo 0,5 g/l) by mělo být nutné jen ve velmi výjimečných případech, např. tehdy, pokud je koncentrace zkoušené chemické látky > 40 mg C/l. Zásobní roztoky by měly být skladovány v chladničce a zlikvidovány po šesti měsících, nebo dříve, pokud dochází k tvorbě sraženin nebo růstu mikroorganismů. Připraví se tyto zásobní roztoky:
|
a)
|
Bezvodý dihydrogenfosforečnan draselný (KH2PO4) 8,50 g
Bezvodý hydrogenfosforečnan draselný (K2HPO4) 21,75 g
Dihydrát hydrogenfosforečnanu sodného (Na2HPO4.2H2O) 33,40 g
Chlorid amonný(NH4Cl) 0,50 g
Rozpustí se ve vodě a doplní na 1 litr. pH tohoto roztoku musí být 7,4 (± 0,2). Pokud tomu tak není, připraví se nový roztok.
|
|
b)
|
Dihydrát chloridu vápenatého (CaCl2.2H2O) 36,40 g
Rozpustí se ve vodě a doplní na 1 litr.
|
|
c)
|
Heptahydrát síranu hořečnatého (MgSO4.7H2O) 22,50 g
Rozpustí se ve vodě a doplní na 1 litr.
|
|
d)
|
Hexahydrát chloridu železitého (FeCl3.6H20) 0,25 g
Rozpustí se ve vodě a doplní na 1 litr a přidá se kapka koncentrované kyseliny chlorovodíkové.
|
|
Příprava minerálního média
|
19.
|
Smísí se 10 ml roztoku a) s přibližně 800 ml vody (odstavec 17), přidá se po 1 ml roztoků b), c) a d) a doplní se vodou na 1 litr (odstavec 17).
|
Další činidla
|
20.
|
Koncentrovaná kyselina orthofosforečná (H3PO4) (> 85 % hmotnosti na objem).
|
Roztok hydroxidu sodného 7M
|
21.
|
V litru vody se rozpustí 280 g hydroxidu sodného (NaOH) (odstavec 17). Stanoví se koncentrace DIC tohoto roztoku a tato hodnota se bere v úvahu při výpočtu výsledku zkoušky (viz odstavce 55 a 61), zejména ve světle kritéria validity v odstavci 66 b). Pokud je koncentrace DIC příliš vysoká, použije se čerstvě připravený roztok.
|
Zkoušená látka
|
22.
|
Připraví se zásobní roztok zkoušené chemické látky dostatečně rozpustné ve vodě (odstavec 17) nebo ve zkušebním médiu (odstavec 19) v koncentraci optimálně stonásobně vyšší, než bude výsledná koncentrace při zkoušce; může být nutné upravit pH zásobního roztoku. Zásobní roztok se přidá do minerálního média tak, aby konečná koncentrace organického uhlíku byla 2 až 40 mg C/l, optimálně 20 mg C/l. Při použití nižších koncentrací může dojít k omezení výsledné přesnosti. Rozpustné i nerozpustné kapalné chemické látky mohou být do nádob dávkovány přímo stříkačkami s vysokou přesností. Málo rozpustné a nerozpustné zkoušené chemické látky mohou vyžadovat speciální zacházení (25). Lze použít následující postupy:
|
a)
|
přímý přídavek známých odvážených množství;
|
|
b)
|
dispergace ultrazvukem před přidáním;
|
|
c)
|
dispergace za přídavku emulgačních činidel, která bude nezbytná pro zjištění, zda mají inhibiční nebo stimulační účinky na mikrobiální aktivitu před přidáním;
|
|
d)
|
adsorpce kapalných zkoušených chemických látek nebo roztoku ve vhodném těkavém rozpouštědle, na inertním nosiči nebo prostředí (např. filtr ze skleněných vláken) s následným odpařením rozpouštědla, pokud bylo použito, a přímé přidání známého množství;
|
|
e)
|
přidání známého množství roztoku zkoušené chemické látky v lehce těkavém rozpouštědle do prázdné zkušební nádoby a následné odpaření rozpouštědla.
|
Prostředky nebo rozpouštědla užitá v písmenech c), d) a e) musí být testovány na případné stimulační nebo inhibiční účinky na mikrobiální aktivitu (viz odstavec 42 (b)).
|
Referenční chemická látka
|
23.
|
Připraví se zásobní roztok (rozpustné) referenční chemické látky ve vodě (odstavec 17) v koncentraci optimálně stonásobně vyšší než bude výsledná koncentrace (20 mg C/l) při zkoušce.
|
Kontrola inhibice
|
24.
|
U zkoušených chemických látek často nedochází k významnému rozkladu za podmínek užitých při stanovení snadného biologického rozkladu. Jednou z možných příčin je to, že zkoušená látka působí inhibičně na inokulum v koncentraci užité při zkoušce. Do zkoušky může být zahrnuta kontrola inhibice s cílem usnadnit (zpětnou) identifikaci inhibice jako možné příčiny nebo přispívajícího faktoru. Kontrola inhibice může rovněž vyloučit takové interference a prokázat, že nulový nebo jen mírný rozklad je důsledkem výhradně nedostatečné náklonnosti k mikrobiologickému napadení za podmínek zkoušky. Pro získání informací o toxicitě zkoušené chemické látky pro (aerobní) mikroorganismy se připraví roztok ve zkušebním médiu obsahujícím zkoušenou látku a referenční chemickou látku (bod 19) obsahující stejnou koncentraci jak zkoušené chemické látky, tak referenční chemické látky (viz odstavec 22 a 23).
|
Inokulum
|
25.
|
Inokulum lze získat z řady zdrojů: z aktivovaného kalu, ze splaškových vod (nechlorovaných), z povrchových vod a půd nebo z jejich směsi (20). Aktivita zdroje z hlediska biologického rozkladu se ověří referenční látkou. Bez ohledu na zdroj by v případě, že se postup má užít jako zkouška na snadnou biologickou rozložitelnost, neměly použít mikroorganismy, které byly již dříve vystaveny působení zkoušené chemické látky.
|
Upozornění:
|
Aktivovaný kal, odpadní voda a splašková voda obsahují patogenní organismy a je nutno s nimi zacházet s opatrností.
|
|
|
26.
|
Na základě zkušeností se optimálním objemem inokula rozumí:
|
—
|
objem, který vykazuje dostatečnou aktivitu k biologickému rozkladu,
|
|
—
|
objem, který rozkládá referenční látku v dohodnuté procentuální míře (viz odstavec 66)
|
|
—
|
objem obsahující 102 až 105 kolonie tvořících jednotek v 1 ml konečné směsi,
|
|
—
|
objem, který obvykle poskytuje koncentraci sušiny aktivovaného kalu ve výsledné směsi 4 mg/l (koncentrace až do 30 mg/l jsou možné, mohou však významně ovlivnit produkci CO2 slepého stanovení (26),
|
|
—
|
objem, který poskytuje koncentraci rozpuštěného organického uhlíku v inokulu menší než 10 % počáteční koncentrace organického uhlíku v přidané zkoušené látce,
|
|
—
|
obecně objem 1–10 ml inokula na litr zkoušeného roztoku.
|
|
Aktivovaný kal
|
27.
|
Odebere se čerstvý vzorek aktivovaného kalu z aerační nádrže čistírny odpadních vod nebo laboratorní jednotky čistící převážně domovní odpadní vody. Pokud je to nutné, odstraní se hrubé částice filtrací sítem (např. s velikostí ok 1 mm2) a kal se udržuje za aerobních podmínek.
|
|
28.
|
Kal se může po odstranění hrubých částic také usadit nebo odstředit (např. 1 100 × g po dobu 10 minut). Kapalná fáze nad usazeninou se odstraní. Kal lze promýt minerálním roztokem. Koncentrovaný kal se suspenduje v minerálním médiu na koncentraci 3–5 g suspendovaných tuhých látek na litr. Následně se kal před použitím provzdušňuje.
|
|
29.
|
Kal by měl být odebrán z dobře fungující konvenční čistírny. Je-li nutné odebrat kal z čistírny s vysokým výkonem, nebo předpokládá-li se, že kal obsahuje inhibitory, je třeba jej promýt. Po důkladném promíchání se kal nechá usadit nebo se odstředí, kapalina nad usazeninou se odstraní a promytý kal se opět suspenduje v nové dávce minerálního média. Tento postup se opakuje, dokud se kal nepovažuje za prostý přebytečného substrátu nebo inhibitoru.
|
|
30.
|
Po opakovaném suspendování nebo z neupravovaného kalu se těsně před použitím odebere vzorek pro stanovení hmotnosti sušiny suspendovaných tuhých látek.
|
|
31.
|
Další možností je homogenizace aktivovaného kalu (3–5 g suspendovaných látek v litru). Kal se 2 minuty rozmělňuje v mixeru Waring při střední rychlosti. Rozmělněný kal se nechá 30 minut (popřípadě déle) usazovat a kapalina se dekantuje pro použití jako inokulum v koncentraci 10 ml/l minerálního média.
|
|
32.
|
Aby se ještě dále snížila hodnota slepého stanovení CO2, může být kal před použitím aklimatizován provzdušňováním přes noc vzduchem bez obsahu CO2. Jako inokulum se při této zkoušce použije koncentrace sušiny aktivovaného kalu 4 mg/l.
|
Inokulum z druhého stupně čistírny odpadních vod
|
33.
|
Inokulum lze získat rovněž z výstupu druhého stupně čistírny odpadních vod nebo laboratorní jednotky zpracovávající převážně domovní odpadní vody. Tento vzorek se udržuje v aerobních podmínkách a používá se v den odběru nebo podle potřeby po aklimatizaci. Z odtoku se odstraní větší částice filtrací přes hrubý filtr a změří se hodnota pH.
|
|
34.
|
Filtrát se za účelem snížení obsahu IC provzdušňuje vzduchem bez CO2 (odstavec 15-e) po dobu 1 h, přičemž se hodnota pH udržuje na 6,5 kyselinou fosforečnou (odstavec 20). Potom se hodnota pH upraví na původní hodnotu hydroxidem sodným (odstavec 21) a nakonec se vzorek ponechá v klidu po dobu 1 h a vhodný objem kapalné fáze se použije pro inokulaci. Tento postup snižuje obsah IC inokula. Jestliže se například použije jako inokulum maximálně 100 ml filtrovaného provzdušněného odtoku na 1 litr, mělo by se při slepém stanovení množství vznikajícího IC pohybovat v rozmezí od 0,4 do 1,3 mg/l (14), což představuje 2–6,5 % zkoušené chemické látky C při 20 mg C/l a 4–13 % při 10 mg C/l.
|
Povrchové vody
|
35.
|
Odebere se vzorek vhodné povrchové vody. Vzorek se uchovává za aerobních podmínek a použije se v den odběru. Podle potřeby se vzorek koncentruje filtrací nebo odstředěním. Objem inokula, které má být použito v jednotlivých zkušebních nádobách, by měl splňovat kritéria uvedená v odstavci 26.
|
Půdy
|
36.
|
Odebere se vzorek vhodné půdy do maximální hloubky 20 cm pod povrchem. Ze vzorku půdy se nejprve odstraní kameny, zbytky rostlin a bezobratlých a půda se následně proseje přes síto o velikosti oka 2 mm (v případě, že vzorek je příliš mokrý na to, aby ho bylo možné prosít okamžitě, částečně se usuší na vzduchu pro usnadnění prosévání). Vzorek se uchová v aerobních podmínkách a musí být použit v týž den, kdy byl odebrán. (Je-li vzorek přepravován ve volně uzavřeném černém polyethylenovém sáčku, lze jej v tomto sáčku skladovat při 2 až 4 °C po dobu až jednoho měsíce.)
|
Aklimatizace inokula
|
37.
|
Inokulum lze aklimatizovat pro experimentální podmínky, ale nikoli předběžně adaptovat na zkoušenou chemickou látku. Aklimatizace může snížit uvolňování CO2 ve slepých pokusech. Aklimatizace spočívá v aeraci aktivovaného kalu po jeho rozpuštění ve zkušebním médiu na 30 mg/l vlhkým vzduchem bez obsahu CO2 po dobu 5 až 7 dnů při zkušební teplotě.
|
POSTUP ZKOUŠKY
Počet lahviček
|
38.
|
Počet potřebných zkušebních lahviček (odstavec 15-a) závisí na četnosti analýz a na trvání testu.
|
|
39.
|
Doporučuje se provést analýzu lahviček třikrát po uplynutí dostatečného počtu časových intervalů tak, aby bylo možno identifikovat desetidenní období rozkladu. Na konci zkoušky se rovněž analyzuje nejméně pět zkušebních lahviček (odstavec 15 písm. a)) ze sady a), b) a c) (viz odstavec 42) s cílem umožnit výpočet 95 % intervalů spolehlivosti pro průměrnou hodnotu biologického rozkladu v procentech.
|
Inokulované médium
|
40.
|
Inokulum se používá v koncentraci sušiny v aktivovaném kalu 4 mg/l. Dostatečně inokulované médium se připraví bezprostředně před použitím například přidáním 2 ml vhodně upraveného aktivovaného kalu (odstavce 27 až 32) na 2 000 mg/l na 1 litr média s minerálními solemi (odstavec 19). Při použití výstupu z druhého stupně čistírny odpadních vod se přidá až 100 ml odtoku (odstavec 33) do 900 ml média s minerálními solemi (odstavec 19) a zředí se médiem na 1 litr.
|
Příprava lahviček
|
41.
|
Alikvotní díly inokulovaného média se rozdělí do duplikátních lahviček tak, aby se poměr mezi plynnou a kapalnou fází rovnal 1:2 (přidá se např. 107 ml do lahviček o kapacitě 160 ml). Lze použít i jiné poměry, ale je nutno dbát upozornění uvedeného v odstavci 11. Při použití jednoho i druhého typu inokula je nutno zajistit, aby bylo inokulované médium odpovídajícím způsobem promícháno s cílem zajistit jeho rovnoměrné rozdělení do zkušebních lahviček.
|
|
42.
|
Připraví se sady lahviček (odstavec 15a), které budou obsahovat:
|
a)
|
zkušební nádoby (označené FT), obsahující zkoušenou chemickou látku;
|
|
b)
|
nádoby pro slepé stanovení (označené FB) obsahující jen zkušební médium a inokulum; je nutné přidat rovněž veškeré chemické látky, rozpouštědla, činidla nebo filtry ze skelných vláken užívané k zavedení zkoušené chemické látky do zkušebních nádob;
|
|
c)
|
nádoby pro kontrolu postupu (označené FC), obsahující referenční chemickou látku;
|
|
d)
|
podle potřeby nádoby pro kontrolu možného inhibičního vlivu zkoušené chemické látky (označené FI) obsahující zkoušenou chemickou látku a referenční chemickou látku ve stejné koncentraci (odstavec 24) jako v lahvích FT (zkoušená látka) a FC, (referenční látka);
|
|
e)
|
nádoby pro kontrolu případného biotického rozkladu (označeného FS), jako v bodě a) plus 50 mg/l HgCl2, nebo sterilizované jiným způsobem (např. v autoklávu).
|
|
|
43.
|
Ve vodě rozpustné zkoušené chemické látky a referenční chemické látky se přidají jako vodné zásobní roztoky (odstavce 22, 23 a 24) tak, aby výsledná koncentrace byla 10 až 20 mg C/l.
|
|
44.
|
Nerozpustné zkoušené chemické látky a nerozpustné referenční chemické látky se přidávají do lahviček celou řadou různých způsobů (viz odstavec 22a-e) v závislosti na povaze zkoušené látky, a to buď před přidáním inokulovaného média, nebo po něm v závislosti na metodě expozice zkoušené chemické látky. Pokud se užije některý z postupů uvedených v odstavci 22a-e, bude se slepými lahvičkami FB (odstavec 42b) zacházeno podobným způsobem, avšak bez přidání zkoušené chemické látky nebo referenční chemické látky.
|
|
45.
|
Těkavé zkoušené chemické látky je třeba vstříknout do uzavřených lahviček (bod 47) s použitím injekční mikrostříkačky. Dávka se vypočítá ze vstříknutého objemu a z hustoty zkoušené chemické látky.
|
|
46.
|
Potom se v případě potřeby do nádob přidá voda tak, aby objem kapaliny byl ve všech nádobách stejný. Poměr mezi plynnou a kapalnou fází (obvykle 1:2) a koncentrace zkoušené látky musí zajistit dostatečnou koncentraci kyslíku v plynné fázi pro úplný biologický rozklad.
|
|
47.
|
Všechny lahve se poté těsně uzavřou, například pryžovými septy z butylkaučuku a hliníkovými lemovacími uzávěry. V této fázi jsou přidány těkavé zkoušené chemické látky (bod 45). Pokud má být sledován pokles koncentrace DOC ve zkušebním roztoku a provedeny analýzy počáteční koncentrace IC v čase nula (sterilní kontroly, bod 42e) nebo jiné determinanty, příslušný vzorek se odstraní ze zkušební nádoby. Zkušební nádoba a její obsah jsou pak vyřazeny.
|
|
48.
|
Těsně uzavřené lahvičky se umístí na orbitální třepačku (odstavec 15d) při rychlosti zajišťující dostatečné promíchání obsahu zkušebních nádob a v suspenzi (např. 150 až 200 otáček za minutu), a jsou inkubovány v temnu při teplotě 20 °C ± 1 °C.
|
Odběr vzorků
|
49.
|
Vzorec odběru vzorků závisí na trvání lagové fáze a na kinetické rychlosti biologického rozkladu zkoušené chemické látky. Vybrané nádoby se analyzují v den vzorkování, ale nejméně jednou za týden nebo častěji (např. dvakrát týdně), jestliže se požaduje celková křivka biologické rozložitelnosti. Z třepačky se odstraní potřebný počet opakovaných vzorků odpovídajících FT, FB a FC a pokud byly nasazeny také FI a FS (viz odstavec 42). Zkouška musí obvykle probíhat 28 dní. Zkouška může být ukončena před uplynutím 28 dní, jestliže z křivky biologické rozložitelnosti vyplývá, že prodlevy bylo dosaženo již dříve. Odeberou se vzorky pro analýzu z pěti lahví rezervovaných pro 28. den zkoušky a výsledky se použijí k výpočtu mezí spolehlivosti nebo variačního koeficientu procenta biologického rozkladu. Z lahviček představujících kontrolní vzorky pro inhibici a abiotický rozklad nemusí být vzorky odebírány tak často jako z ostatních lahviček; postačí odběr v 1. den a v 28. den.
|
Analýza anorganického uhlíku (IC)
|
50.
|
Produkce CO2 v lahvičkách se stanoví měřením zvýšení koncentrace anorganického uhlíku (IC) v průběhu inkubace. Existují dvě doporučené metody stanovení množství IC vznikajícího během zkoušky, které jsou popsány bezprostředně níže. Tyto metody mohou poskytovat poněkud odlišné výsledky, a proto by během zkoušky měla být používána jen jedna z nich.
|
|
51.
|
Metoda a) se doporučuje v případě, že médium pravděpodobně obsahuje zbytky například skleněného filtračního papíru a/nebo nerozpustné zkoušené chemické látky. Pokud není k dispozici analyzátor uhlíku, lze tuto analýzu provést pomocí plynového chromatografu. Je důležité, aby láhve měly při analýze plynu v plynné fázi zkušební teplotu nebo se jí alespoň blížily. Metoda b) může být jednodušší pro laboratoře, které užívají pro měření IC analyzátory uhlíku. Je důležité, aby roztok hydroxidu sodného (odstavec 21), který slouží k přeměně CO2 na uhličitan, byl buď čerstvě připravený, nebo byl znám jeho obsah IC, aby jej bylo možno zohlednit při výpočtu výsledků zkoušek (viz odstavec 66-b).
|
Metoda a): okyselení na hodnotu pH < 3
|
52.
|
Před analýzou každé šarže se analyzátor uhlíku kalibruje vhodným IC standardem (např. dusíkem s hmotnostním podílem CO2 1 %). Septem se vstříkne do každé zkušební nádoby koncentrovaná kyselina fosforečná (odstavec 20), aby se hodnota pH média snížila na < 3 (přidá se například 1 ml kyseliny na každých 107 ml zkušebního média). Potom se nádoby znovu umístí na třepačku. Po 1 h třepání při zkušební teplotě se nádoby sejmou z třepačky a z každé zkušební nádoby se odebere alikvotní podíl (např. 1 ml) plynné fáze a vstříkne se do analyzátoru uhlíku. Zaznamenají se naměřené koncentrace IC (v mg C na litr plynu).
|
|
53.
|
Podstata této metody spočívá v tom, že po okyselení na pH < 3 a po dosažení rovnováhy při 20 °C je rovnovážná konstanta pro distribuci CO2 mezi kapalnou a plynnou fází ve zkušebních nádobách rovna 1,0, pokud je měřena jako koncentrace (13). To by mělo být nejméně jednou ověřeno pro zkušební systém následujícím způsobem:
Připraví se zkušební nádoby obsahující roztok bezvodého uhličitanu sodného (Na2CO3) ve vodě prosté CO2 o koncentracích odpovídajících 5 a 10 mg IC na litr, přičemž voda prostá CO2 se připraví okyselením vody na pH 6,5 koncentrovanou kyselinou orthofosforečnou (odstavec 20), kterou se přes noc prohání vzduch prostý CO2 a nakonec se pH sníží přidáním zásady na neutrální hodnotu. Zajistí se, aby poměr mezi plynnou a kapalnou fází byl stejný jako při vlastní zkoušce (např. 1:2). Obsah v nádobách se okyselí a po dosažení rovnováhy, jak je uvedeno v odstavci 52, se stanoví koncentrace IC v plynné i kapalné fázi. Ověří se, zda v rámci experimentální chyby jsou obě koncentrace stejné. V případě, že tomu tak není, experimentátor by měl uvedené postupy přehodnotit. Tuto kontrolu distribuce IC mezi plynnou a kapalnou fází není nutné provádět vždy při provedení testu; lze ji provádět nejspíše při provádění kalibrace.
|
|
54.
|
Jestliže má být stanoven úbytek DOC (platí pouze pro vodou rozpustné zkoušené chemické látky), odeberou se vzorky kapalné fáze ze samostatných (neokyselených) nádob, filtrují se membránovým filtrem a vstříknou do DOC analyzátoru. Tyto nádoby lze podle potřeby užít pro další analýzy s cílem stanovit primární biologický rozklad.
|
Metoda b): přeměna CO2 na uhličitany
|
55.
|
Před analýzou každé šarže se analyzátor IC kalibruje na vhodný standard – například roztokem hydrogenuhličitanu sodného (NaHCO3) ve vodě prosté CO2 (viz odstavec 53) v koncentračním rozsahu IC od 0 mg/l do 20 mg/l. Septem se do každé zkušební lahvičky vstříkne 1 ml roztoku hydroxidu sodného (7M, odstavec 21) (např. 1 ml do 107 ml média) a nádobami se třepe při zkušební teplotě po dobu 1 h. Tentýž roztok NaOH se použije pro všechny lahvičky užité v daném dni, avšak není nutno jej užívat při každém odběru vzorků v průběhu zkoušky. Jestliže jsou při všech odběrech vzorků požadovány absolutní slepé hodnoty IC, bude stanovení IC v roztoku NaOH požadováno při každém jeho použití. Nádoby se sejmou z třepačky a nechají se odsadit. Z každé nádoby se stříkačkou odebere vhodný objem kapalné fáze (např. od 50 μl do 1 000 μl). Vzorky se vstříknou do analyzátoru IC a zaznamenají se koncentrace IC. Je třeba zajistit, aby užívaný analyzátor byl řádně vybaven ke zpracování zásaditých vzorků vytvořených v rámci této metody.
|
|
56.
|
Podstata této metody spočívá v tom, že po přídavku zásady a třepání je koncentrace IC v plynné fázi zanedbatelná. To by mělo být ověřeno pro zkušební systém nejméně jednou s použitím standardů IC, přidáním zásady a ustálením a změřením koncentrace IC v plynné i kapalné fázi (viz odstavec 53). Koncentrace v plynné fázi by se měla blížit nule. Tuto kontrolu na téměř kompletní absorpci CO2 není nutno provádět při každé zkoušce.
|
|
57.
|
Jestliže má být stanoven úbytek DOC (platí pouze pro vodou rozpustné zkoušené chemické látky), odeberou se vzorky kapalné fáze ze samostatných nádob (které neobsahují přidanou zásadu), filtrují se membránovým filtrem a vstříknou do DOC analyzátoru. Tyto nádoby lze podle potřeby užít pro další analýzy s cílem stanovit primární biologickou rozložitelnost.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Výpočet výsledků
|
58.
|
Za předpokladu 100 % mineralizace zkoušené chemické látky na CO2 se teoretická produkce anorganického uhlíku (ThIC), která je větší než produkovaná slepým stanovením, rovná množství celkového organického uhlíku (TOC) přidaného do každé zkušební nádoby na začátku zkoušky, takže:
Celkový objem anorganického uhlíku (TIC) v každé zkušební nádobě je:
|
|
rovnice [1]
|
kde:
|
VL
|
=
|
objem kapaliny v láhvi (v litrech),
|
|
CL
|
=
|
koncentrace IC v kapalné fázi (v mg uhlíku na 1 litr kapalné fáze),
|
|
VH
|
=
|
objem plynné fáze (v litrech),
|
|
CL
|
=
|
koncentrace IC v plynné fázi (v mg uhlíku na 1 litr plynné fáze).
|
Výpočet TIC pro tyto dvě analytické metody užívané ke stanovení IC při této zkoušce je popsán níže v odstavcích 60 a 61. Procento biologického rozkladu (% D) se pro každý případ vypočte podle:
|
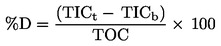
|
Rovnice [2]
|
kde:
|
TICt
|
=
|
TIC ve zkušební nádobě v čase t v miligramech,
|
|
TICb
|
=
|
průměrná hodnota TIC v nádobách pro slepé stanovení v čase t v miligramech,
|
|
TOC
|
=
|
TOC původně přidaný do zkušební nádoby v miligramech.
|
Procento biologického rozkladu % D se vypočte ve zkušebních nádobách (FT), referenčních nádobách (FC) a nádobách pro kontrolu inhibice z příslušného množství TIC produkovaného při každé době odběru vzorku (pokud byly zařazeny).
|
|
59.
|
Jestliže došlo během zkušební doby k významnému vzrůstu TIC sterilních kontrol (FS), pak lze dospět k závěru, že došlo k abiotickému rozkladu zkoušené chemické látky a tuto skutečnost je třeba zohlednit ve výpočtu D v rovnici [2].
|
Okyselení na hodnotu pH < 3
|
60.
|
Vzhledem k tomu, že okyselení na hodnotu pH < 3 a ustálení má za následek dosažení rovnováhy mezi koncentrací TIC v kapalné a plynné fázi, stačí měřit jen koncentraci IC v plynné fázi. Proto je v rovnici [1]
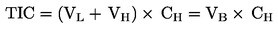
, kde VB = je objem lahve se sérovým uzávěrem. |
Přeměna CO2 na uhličitany
|
61.
|
Při této metodě se výpočty provádějí, jak je popsáno v rovnici [1], avšak zanedbatelný obsah IC v plynné fázi se nebere v úvahu, to znamená, že
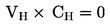
, a
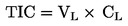
. |
Vyjadřování výsledků
|
62.
|
Křivka biologického rozkladu se získá vynesením závislosti procenta biologického rozkladu D na čase inkubace, a pokud možno se vyznačí také lagová fáze, doba biologického rozkladu, 10denní období rozkladu a prodleva, tj. fáze, v níž bylo dosaženo maximálního rozkladu a v níž se vyrovnala křivka biologického rozkladu. Jestliže se pro dvě souběžná stanovení ve zkušebních nádobách FT (rozdíl menší než 20 %) získají srovnatelné výsledky, vynesou se do grafů průměrné hodnoty (viz dodatek 2, obr. 1); v opačném případě se vynesou křivky pro každou nádobu zvlášť. Zjistí se průměrná hodnota biologického rozkladu v procentech v prodlevě nebo se odhadne nejvyšší hodnota (například když křivka v prodlevě klesá), ale je důležité stanovit, že v tomto druhém případě se nejedná o odlehlou hodnotu. Tento maximální stupeň biologického rozkladu se v protokolu o zkoušce uvede jako „stupeň biologického rozkladu zkoušené chemické látky“. Jestliže počet zkušebních nádob nebyl dostatečný pro odhad prodlevy, použijí se údaje změřené poslední den zkoušky a vypočte se průměrná hodnota. Tato poslední hodnota, průměr pěti opakovaných zkoušek, slouží jako indikátor přesnosti, s nímž bylo stanoveno procento biologického rozkladu. Uvede se rovněž hodnota získaná na konci 10denního období rozkladu.
|
|
63.
|
Stejným způsobem se vynese křivka biologického rozkladu pro referenční látku FC, a pokud byla provedena, i pro závislost abiotické eliminace FS a kontroly inhibice FI.
|
|
64.
|
Zaznamená se produkce TIC při slepém stanovení (FB) a v nádobách pro kontrolu abiotické eliminace (FS), pokud byly tyto nádoby zařazeny do zkoušky.
|
|
65.
|
Vypočte se D pro nádoby FI na základě teoretické produkce IC předpokládané pouze na základě referenční složky směsi. Jestliže je 28. den [(DFC
(22) – DFI
(23))/DFC] × 100 > 25 %, lze předpokládat, se zkoušená chemická látka působí inhibičně na aktivitu inokula, a to může být důsledkem nízkých hodnot DFT získaných za podmínek zkoušky. V tomto případě by mohla být zkouška opakována s nižší zkušební koncentrací, a pokud možno se snížením DIC v inokulu a TIC vytvořeného ve slepých kontrolních nádobách vzhledem k tomu, že nižší koncentrace jinak sníží přesnost této metody. V úvahu přichází i použití jiného inokula. Jestliže v nádobě FS (abiotické) byl pozorován významný nárůst (> 10 %) množství TIC, mohou přicházet v úvahu procesy abiotického rozkladu.
|
Platnost výsledků
|
66.
|
Zkouška se považuje za platnou, jestliže:
|
a)
|
průměrné procento rozkladu v nádobách FC s referenční látkou je po 14 dnech inkubace > 60 % a
|
|
b)
|
průměrná produkce TIC při slepých stanoveních FB na konci zkoušky je > 3 mg C/l.
|
Pokud není těchto limitů dosaženo, měla by se zkouška opakovat s inokulem z jiného zdroje, případně by měl být přezkoumán užitý postup. Pokud je například problémem vysoká produkce IC při slepých stanoveních, je nutno opakovat postup uvedený v odstavcích 27 až 32.
|
|
67.
|
Pokud zkoušená látka nedosáhne 60 % ThIC a bylo prokázáno, že není inhibující (odstavec 65), lze zkoušku opakovat s vyšší koncentrací inokula (až 30 mg/l aktivovaného kalu a 100 ml odtoku/l) nebo s inokuly z jiných zdrojů, zejména tehdy, pokud byl rozklad v rozmezí 20 až 60 %.
|
Interpretace výsledků
|
68.
|
Biologický rozklad > 60 % ThIC v rámci 10denního období rozkladu v této zkoušce prokazuje, že zkoušená chemická látka je snadno biologicky rozložitelná v aerobních podmínkách.
|
|
69.
|
Pokud není dosaženo vyhovující hodnoty 60 % ThIC, určí se hodnota pH v médiích v lahvičkách, které nebyly upraveny kyselinou ani zásadou; hodnota menší než 6,5 by mohla znamenat, že došlo k nitrifikaci. V takovém případě se zkouška opakuje s roztokem pufru o vyšší koncentraci.
|
Protokol o zkoušce
|
70.
|
Sestaví se tabulka % D pro každou zkušební nádobu (FT), referenční nádobu (FC) a nádobu pro kontrolu inhibice (FI), pokud byly zařazeny do vzorku, pro každý den odběru vzorku. Pokud jsou získány srovnatelné výsledky pro duplikátní vzorky, vynese se křivka průměrných hodnot % D v reálném čase. Zaznamená se množství TIC ve slepých (FB) a sterilních kontrolách (FS) DOC a/nebo jiné determinanty a jejich procento úbytku.
|
|
71.
|
Určí se průměrná hodnota procenta D ve fázi prodlevy, nebo se použije nejvyšší hodnota, pokud křivka biologického rozkladu ve fázi prodlevy klesá, a tato skutečnost se uvede jako „stupeň biologického rozkladu zkoušené chemické látky“. Je důležité zajistit, aby v tomto druhém případě nejvyšší hodnota nebyla hodnotou odlehlou.
|
|
72.
|
Protokol o zkoušce musí obsahovat tyto údaje:
|
|
Zkoušená chemická látka:
|
—
|
obecný název, chemický název, číslo CAS, strukturní vzorec a relevantní fyzikálně-chemické vlastnosti,
|
|
—
|
čistota zkoušené látky (obsah nečistot).
|
|
|
|
Zkušební podmínky:
|
—
|
odkaz na tuto zkušební metodu,
|
|
—
|
popis užitého zkušebního systému (např. objem nádoby, poměr mezi plynnou a kapalnou fází, metoda míchání atd.),
|
|
—
|
aplikace zkoušené chemické látky a referenční chemické látky do zkušebního systému: užitá zkušební koncentrace a množství uhlíku dávkovaného do jednotlivých zkušebních nádob; jakékoli užití rozpouštědla,
|
|
—
|
podrobnosti o použitém inokulu, jakákoli adaptace a aklimatizace,
|
|
—
|
validace principu analýzy IC,
|
|
—
|
hlavní charakteristika použitého analyzátoru IC (a jakýchkoli dalších použitých analytických metod),
|
|
—
|
počet duplikátních vzorků.
|
|
|
|
Výsledky:
|
—
|
nezpracovaná data a vypočtené hodnoty biologického rozkladu v tabelární formě,
|
|
—
|
graf závislosti procenta rozkladu na čase u zkoušených a referenčních chemických látek, lagová fáze, fáze rozkladu, 10denní období rozkladu a směrnice,
|
|
—
|
procento úbytku ve fázi prodlevy, na konci zkoušky a po uplynutí 10denního období rozkladu,
|
|
—
|
odůvodnění případného odmítnutí výsledků zkoušky,
|
|
—
|
jakékoli další skutečnosti, které jsou důležité pro užitý postup,
|
|
|
LITERATURA:
|
1)
|
Kapitola C.4 této přílohy – Stanovení „snadné“ biologické rozložitelnosti – Zkouška na uvolňování CO2 (metoda C.4-C).
|
|
2)
|
Sturm RN (1973). Biodegradability of Nonionic surfactants: screening test for predicting rate and ultimate biodegradation. J.A,.Oil Chem Soc. 50: 159–167.
|
|
3)
|
Larson RJ (1979). Estimation of biodegradation potential of xenobiotic organic chemicals. Appl Env. Microbiol. 38: 1153–1161.
|
|
4)
|
Larson RJ, Hansmann MA and Bookland EA (1996). Carbon dioxide recovery in ready biodegradability tests: mass transfer and kinetic constants, Chemosphere 33: 1195–1210.
|
|
5)
|
ISO 9439 (1990; přepracována v roce 1999). Jakost vod – Hodnocení úplné biologické rozložitelnosti organických látek ve vodném prostředí – Metoda stanovení uvolněného oxidu uhličitého (Sturm).
|
|
6)
|
US EPA (1996). Fate, Transport and Transformation Test Guideline. 835. 3110 Carbon dioxide evolution test. Office, Prevention Pesticides and Toxic Substances Washington, DC.
|
|
7)
|
US EPA (1996). Fate, Transport and Transformation Test Guideline. 835. 3100. Aerobic aquatic biodegradation. Office, Prevention Pesticides and Toxic Substances Washington, DC.
|
|
8)
|
Gledhill WE (1975). Screening test for assessment of biodegradability: Linear alkyl benzene sulfonate. Appl Microbiol. 30: 922–929.
|
|
9)
|
Weytjens D, Van Ginneken I and Painter HA (1994). The recovery of carbon dioxide in the Sturm test for ready biodegradability. Chemosphere 28: 801–812.
|
|
10)
|
Ennis DM and Kramer A (1975). A rapid microtechnique for testing biodegradability of nylons and polyamides. J. Food Sci. 40: 181–185.
|
|
11)
|
Ennis DM, Kramer A, Jameson CW, Mazzoccki PH and Bailey PH (1978). Appl. Env. Microbiol. 35: 51–53.
|
|
12)
|
Boatman RJ, Cunningham SL and Ziegler DA (1986). A method for measuring the biodegradation of organic chemicals, Env. Toxicol. Chem. 5: 233–243.
|
|
13)
|
Struijs J and Stoltenkamp J (1990). Head space determination of evolved carbon dioxide in a biodegradability screening test. Ecotox. Env. Safety 19: 204–211.
|
|
14)
|
Birch RR and Fletcher RJ (1991). The application of dissolved inorganic carbon measurements to the study of aerobic biodegradability. Chemosphere 23: 507–524.
|
|
15)
|
Birch RR, Biver C, Campagna R, Gledhill WE, Pagga U, Steber J, Reust H, and Bontinck WJ (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19: 1527–1550.
|
|
16)
|
ISO 14593, (1999) Jakost vod – Hodnocení úplné aerobní biologické rozložitelnosti organických látek ve vodním prostředí – Metoda stanovení anorganického uhlíku v těsně uzavřených lahvičkách (C02 headspace metoda).
|
|
17)
|
Battersby NS (1997). The ISO headspace C02 biodegradation test, Chemosphere 34: 1813–1822.
|
|
18)
|
US EPA (1996). Fate, Transport and Transportation. 835,3120. Sealed vessel carbon dioxide production test. Office, Prevention Pesticides and Toxic Substance, Washington, DC.
|
|
19)
|
Battersby NS, Ciccognani D, Evans MR, King D, Painter HA, Peterson DR and Starkey M (1999). An „inherent“ biodegradability test for oil products: description and results of an international ring test. Chemosphere 38: 3219–3235.
|
|
20)
|
Kapitola C.4 této přílohy – Stanovení „snadné“ biologické rozložitelnosti.
|
|
21)
|
OECD (1988). OECD Ring-test of methods for determining ready biodegradability: Chairman’s report (M. Hashimoto; MITI) and final report (M. Kitano and M. Takatsuki; CITI). Paris.
|
|
22)
|
Kapitola C.11 této přílohy – Zkouška na inhibici dýchání aktivovaného kalu.
|
|
23)
|
Struijs J, Stoltenkamp-Wouterse MJ and Dekkers ALM (1995). A rationale for the appropriate amount of inoculum in ready biodegradability tests. Biodegradation 6: 319–327.
|
|
24)
|
EU (1999). Ring-test of the ISO Headspace CO2 method: application to surfactants: Surfactant Ring Test-1, Report EU4697, Water Research Centre, May 1999, Medmenham, SL7 2HD, UK.
|
|
25)
|
ISO 10634 (1996) Jakost vod – Pokyny pro přípravu a zpracování ve vodě těžko rozpustných organických látek pro následující hodnocení jejich biologické rozložitelnosti ve vodním prostředí.
|
Dodatek 1
ZKRATKY A DEFINICE
IC: Anorganický uhlík (Inorganic carbon).
TCO2: Teoretický oxid uhličitý (theoretical carbon dioxide, ThCO2) (mg) je množství oxidu uhličitého, které by mělo vzniknout ze známého nebo změřeného obsahu uhlíku ve zkoušené chemické látce za předpokladu její úplné mineralizace; vyjadřuje se rovněž v mg oxidu uhličitého uvolněného z 1 mg zkoušené látky.
DOC: Rozpuštěný organický uhlík (dissolved organic carbon) je celkový organický uhlík, který je přítomný v roztoku nebo projde přes filtr o velikosti pórů 0,45 μm nebo zůstane v supernatantu po odstřeďování po dobu 15 minut při odstředivém zrychlení 40 000 m/s–2 (což odpovídá odstředivé síle přibližně 4 000 g)
DIC: Rozpuštěný anorganický uhlík.
ThIC: Teoretická produkce anorganického uhlíku.
TIC: Celkový anorganický uhlík.
Snadno biologicky rozložitelná: je dohodnutá klasifikace chemických látek, které prošly určitými screeningovými zkouškami úplné biologické rozložitelnosti; tyto zkoušky jsou tak přísné, že lze předpokládat, že se látky budou ve vodném prostředí za aerobních podmínek rychle a úplně biologicky rozkládat.
10denní období rozkladu: je 10 dnů, které následují bezprostředně po dosažení 10 % biologického rozkladu.
Biologická rozložitelnost: je klasifikace chemických látek, pro něž existuje nepochybný důkaz o jejich biologické rozložitelnosti (primární nebo konečné) v kterékoli uznávané zkoušce biologické rozložitelnosti.
Úplný aerobní biologický rozklad: je stupeň rozkladu zkoušené látky dosažený po jejím úplném zužitkování mikroorganismy, vedoucí k produkci oxidu uhličitého, vody, minerálních solí a nové mikrobiální buněčné hmoty (biomasy).
Mineralizace: Mineralizace je úplný rozklad organické látky na CO2 a H2O za aerobních podmínek a na CH4, CO2 a H2O za anaerobních podmínek.
Lagová fáze: Čas od začátku zkoušky až do doby dosažení aklimatizace a/nebo adaptace rozkládajících se mikroorganismů a vzrůstu stupně biologického rozkladu zkoušené chemické látky nebo organické chemické látky na detekovatelnou úroveň (např. 10 % maxima teoretického biologického rozkladu nebo nižší v závislosti na přesnosti techniky měření).
Doba rozkladu: Doba od konce lagové fáze až do doby, kdy bylo dosaženo 90 % maximálního stupně biologického rozkladu.
Prodleva (plato): Prodleva je fáze, kdy bylo dosaženo maximálního rozkladu a křivka biologického rozkladu se ustálila.
Zkoušená chemická látka: Jakákoliv látka nebo směs testovaná pomocí této zkušební metody.
Dodatek 2
Příklad křivky biologického rozkladu
Obrázek 1
Biologický rozklad oktan-1-olu CO2 headspace metodou
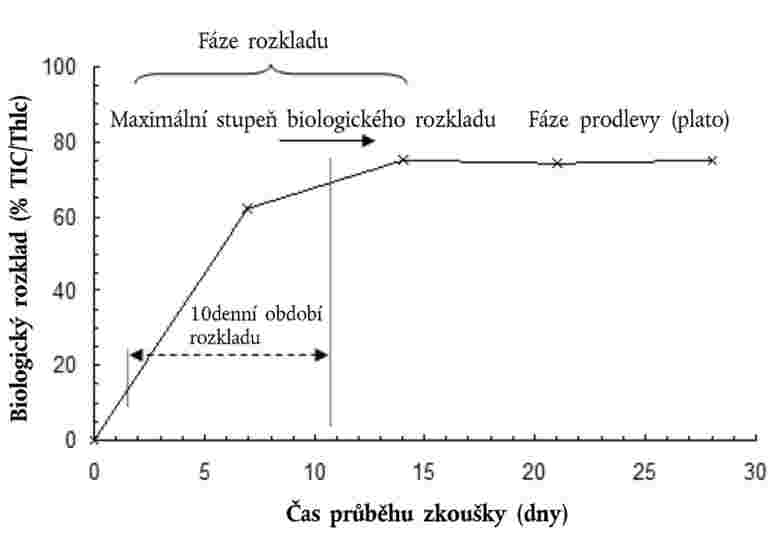
Slovníček
Biologický rozklad:
Fáze rozkladu:
Maximální stupeň biologického rozkladu:
Fáze prodlevy (plato):
10denní období rozkladu:
Čas průběhu zkoušky (dny):
C. 30 BIOAKUMULACE U TERESTRICKÝCH MÁLOŠTĚTINATCŮ
ÚVOD
|
1.
|
Tato zkušební metoda odpovídá pokynu OECD pro zkoušení (TG) 317 (2010). Ze zkušebních metod týkajících se rozpadu v životním prostředí byly v roce 1996 publikovány Bioakumulace: Průtoková zkouška na rybách (kapitola C.13 této přílohy (49)) a v roce 2008 Bioakumulace u bentických máloštětinatců žijících v sedimentu (53). Extrapolovat údaje o bioakumulaci ve vodním prostředí na suchozemské organismy, jako jsou žížaly, je obtížné až nemožné. Pro stanovení bioakumulace chemických látek v půdě se v současné době užívají modelové výpočty založené na lipofilitě zkoušené chemické látky, např. (14, 37), jako např. v technických pokynech EU (19). Potřeba zkušební metody specifické pro určité prostředí již byla vyřešena, např. (55). Tato metoda je zvláště důležitá pro posouzení druhotné otravy v terestrických potravních řetězcích (4). Několik vnitrostátních zkušebních metod řeší problém bioakumulace u jiných organismů než u ryb, např. (2) a (72). Jednu z metod měření bioakumulace z kontaminovaných půd v žížalách (Eisenia fetida, Savigny) a kroužkovcích vyvinula Americká společnost pro zkoušení a materiály (3). Mezinárodně uznávaná metoda pro stanovení bioakumulace v obohacené půdě zlepší posuzování rizik, která představují chemické látky pro terestrické ekosystémy, např. (25, 29).
|
|
2.
|
Půdu přijímající bezobratlí jsou exponováni chemickým látkám vázaným v půdě. Mezi tyto živočichy patří terestričtí máloštětinatci, kteří hrají významnou úlohu ve struktuře a funkci půdy (15), (20). Terestičtí máloštětinatci žijí v půdě a částečně na jejím povrchu (zejména ve vrstvě L) a často reprezentují nejpočetnější druh, pokud jde o biomasu (54). Jelikož tito živočichové víří půdu a slouží jako potrava, mohou mít silný vliv na biologickou dostupnost látek pro jiné organismy, jako jsou bezobratlí (např. draví roztoči a brouci, např. (64)) nebo dravci (např. lišky a racci) z řad obratlovců (18, 62). Některé druhy terestrických máloštětinatců, kteří jsou v současné době využíváni pro ekotoxikologické zkoušky, jsou popsány v dodatku 5.
|
|
3.
|
Řadu podstatných a užitečných údajů pro provedení této zkušební metody bioakumulace v půdě poskytuje dokument „ASTM Standard Guide for Conducting Laboratory Soil Toxicity or Bioaccumulation Tests with the Lumbricid Earthworm Eisenia fetida and the Enchytraeid Potworm Enchytraeus albidus“ 3). Dalšími dokumenty, na které tato zkušební metoda odkazuje, je kapitola C.13 této přílohy Bioakumulace: Průtoková zkouška na rybách (49) a OECD TG 315: Bioakumulace u bentických máloštětinatců žijících v sedimentu (53). Významným zdrojem informací pro tuto zkušební metodu jsou rovněž praktické zkušenosti se studiemi bioakumulace v půdě a publikovaná literatura, např. (1, 5, 11, 12, 28, 40, 43, 45, 57, 59, 76, 78, 79).
|
|
4.
|
Tato metoda je vhodná zejména pro testování stabilních, neutrálních organických chemických látek, které mají tendenci k adsorpci na půdu. Touto zkušební metodou lze rovněž testovat bioakumulaci s půdou spjatých stabilních organokovových sloučenin. Lze ji použít i pro kovy a jiné stopové prvky.
|
PŘEDPOKLADY
|
5.
|
Zkoušky pro měření bioakumulace chemické látky v pozemních máloštětinatcích byly provedeny s těžkými kovy (viz např. (63)) a persistentními organickými chemickými látkami, jejichž hodnoty log Kow se pohybují mezi 3,0 a 6,0 např. (40). Tyto zkoušky lze použít také pro:
|
—
|
chemické látky, které mají log Kow vyšší než 6,0 (superhydrofobní chemické látky),
|
|
—
|
chemické látky, které patří do kategorie organických látek, o nichž je známo, že mají potenciál bioakumulace v živých organismech, např. povrchově aktivní nebo vysoce adsorpční chemické látky,
|
|
—
|
chemické látky, které vykazují potenciál pro bioakumulaci na základě strukturálních prvků, např. analogy chemické látky se známým bioakumulačním potenciálem, a
|
|
|
6.
|
Informace o zkoušené chemické látce, jako je obecný název, chemický název, (optimálně název podle IUPAC), strukturní vzorec, registrační číslo CAS, čistota, bezpečnostní opatření, vhodné podmínky skladování a analytické metody, by měly být získány před zahájením studie. Kromě toho by měly být známy tyto údaje:
|
b)
|
rozdělovací koeficient oktanol-voda Kow;
|
|
c)
|
rozdělovací koeficient půda-voda vyjádřený jako Koc;
|
|
e)
|
rozložitelnost (např. v půdě, ve vodě);
|
|
|
7.
|
Lze použít radioizotopově značené i neznačené zkoušené chemické látky. Pro usnadnění analýzy se však doporučuje použít radiotopově značenou zkoušenou chemickou látku. Rozhodnutí bude záviset na mezích stanovitelnosti nebo na požadavku na měření výchozí zkoušené chemické látky a metabolitů. Je-li použita radioizotopově značená zkoušená látka a měří-li se celkový obsah radioaktivního zbytku, je pro výpočet bioakumulačního faktoru (BAF) výchozí chemické látky a příslušných půdních metabolitů (viz odstavec 50) důležité, aby radioizotopově značené zbytky v půdě i ve zkušebních organismech a testovací organismy byly charakterizovány procentem výchozí zkoušené chemické látky a značené nevýchozí chemické látky, např. ve vzorcích odebraných v ustáleném stavu nebo na konci fáze příjmu. U měření radioaktivně neznačené organické zkoušené látky nebo kovů může být nutné popsanou metodu upravit například tak, aby vzniklo dostatečné množství biomasy. Měří-li se celkový obsah radioaktivního zbytku (počítáním scintilací v roztoku například po extrakci, spálení nebo solubilizaci tkáně), je hodnota bioakumulačního faktoru založena na výchozí zkoušené chemické látce a na metabolitech. Výpočet BAF by měl být přednostně založen na koncentraci výchozí zkoušené chemické látky v organismech a na celkovém objemu radioaktivních zbytků. Následně by měl být na základě BAF vypočten akumulační faktor sediment-biota (BSAF) normalizovaný na obsah lipidů v červech a obsah organického uhlíku (OC) v půdě z důvodů srovnatelnosti mezi výsledky různých bioakumulačních zkoušek.
|
|
8.
|
Měla by být známa toxicita zkoušené látky pro druh použitý při zkoušce, například koncentrace vyvolávající účinek (ECx) nebo letální koncentrace (LCx) po dobu fáze příjmu (např. (19)). Zvolená koncentrace zkoušené látky by měla v optimálním případě být na úrovni 1 % její asymptotické hodnoty akutní LC50 a měla by být nejméně desetkrát vyšší než je mez detekce této látky v půdě při použité analytické metodě. Pokud je to možné, měla by být dána přednost hodnotám toxicity odvozeným z dlouhodobých studií o subletálních koncových bodech (51, 52). Pokud tyto údaje nejsou k dispozici, poskytne užitečné informace zkouška akutní toxicity (viz např. (23)).
|
|
9.
|
K dispozici musí být vhodná analytická metoda o známé správnosti, přesnosti a citlivosti pro kvantitativní stanovení chemické látky ve zkušebních roztocích, v půdě a v biologickém materiálu a dále podrobnosti o přípravě a uchovávání vzorků a materiálové bezpečnostní listy. Měly by být také známy meze stanovitelnosti zkoušené látky jak v půdě, tak v tkáních červů. Je-li použita zkoušená látka značená 14C, měla by být známá specifická radioaktivita ((tj. Bq/mol) a aktivita nečistot vyjádřená v procentech. Specifická radioaktivita zkoušené chemické látky by měla být dostatečně vysoká, aby umožňovala analýzu a použité zkušební koncentrace by neměly vyvolávat toxické účinky.
|
|
10.
|
Zkoušku je možno provést s umělou půdou nebo s přírodními půdami. U přírodních půd je před zahájením zkoušky třeba znát informace o vlastnosti užité přírodní půdy, jako je například původ půdy nebo jejích složek, pH, obsah organického uhlíku, distribuce částic (procento písku, prachu a jílu) a vodní kapacita (WHC) (3, 48).
|
PODSTATA ZKOUŠKY
|
11.
|
Mezi parametry, které charakterizují bioakumulaci zkoušené chemické látky, patří bioakumulační faktor (BAF), rychlostní konstanta příjmu (ks) a rychlostní konstanta vylučování (ke). Definice jsou uvedeny v dodatku 1.
|
|
12.
|
Zkouška se skládá ze dvou fází: fáze příjmu (expozice) a vylučovací (poexpoziční) fáze. Ve fázi příjmu jsou paralelní vzorky červů vystaveny působení půdy, která byla obohacena zkoušenou chemickou látkou. Zároveň se zkušebními organismy je za stejných podmínek, ale bez zkoušené chemické látky držena kontrolní skupina červů. Měří se hmotnost po vysušení a obsah lipidů ve zkušebních organismech. To lze provést pomocí červů v kontrolní skupině. Analytické hodnoty pozadí (slepé) lze získat analýzou vzorků červů z kontrolní skupiny a půdy. Ve fázi vylučování jsou červi přemístěni do půdy bez zkoušené chemické látky. Fáze vylučování je nutná vždy s výjimkou případů zanedbatelné absorpce zkoušené chemické látky v průběhu fáze expozice. Fáze vylučování poskytuje informace o míře vylučování testované látky zkušebními organismy (např. (27)). Pokud nebylo ve fázi příjmu dosaženo ustáleného stavu, mělo by být stanovení kinetických parametrů – kinetického bioakumulačního faktoru BAFK a rychlostní konstanty (rychlostních konstant) příjmu a vylučování – založeno v optimálním případě na současném proložení výsledků fáze příjmu a fáze vyprázdnění. Koncentrace zkoušené látky v červech a na nich je sledována v průběhu obou fází zkoušky.
|
|
13.
|
Během fáze příjmu se provádí měření v době odběru vzorků po dobu až 14 dnů (roupice) nebo 21 dnů (žížaly), dokud není dosaženo ustáleného stavu (11, 12, 67). Ustálený stav nastává, jestliže vynesení koncentrace červů v čase je rovnoběžné s časovou osou a tři po sobě jdoucí analýzy koncentrací provedené na vzorcích odebraných nejméně v dvoudenních intervalech se vzájemně neliší o více než ± 20 % na základě statistických srovnání (např. analýza rozptylu, regresní analýza).
|
|
14.
|
Fáze vylučování spočívá v přenesení zkušebních organismů do nádob, které obsahují stejný substrát bez obsahu zkoušené chemické látky. V průběhu fáze vyprázdnění se měření provádějí v době odběru vzorků po dobu až 14 dnů (roupice) nebo 21 dnů (žížaly), pokud již dříve nebylo analyticky stanoveno 90 % snížení reziduí zkoušené chemické látky v červech. Koncentrace zkoušené chemické látky v červech na konci fáze vyprázdnění se uvede jako neodstraněná rezidua. Bioakumulační faktor ustáleného stavu (BAFSS) se optimálně vypočte jako poměr koncentrace v červech (Ca) a v půdě (Cs) ve zřetelném ustáleném stavu, a jako kinetický bioakumulační faktor BAFK, tj. poměr rychlostní konstanty příjmu z půdy (ks) a rychlostní konstanty vylučování (ke) (definice viz dodatek 1) za předpokladu kinetiky prvního řádu (výpočty viz dodatek 2). Pokud kinetiku prvního řádu zjevně nelze použít, měly by být použity jiné modely.
|
|
15.
|
Rychlostní konstanta příjmu, rychlostní konstanta (nebo konstanty, jsou-li použity složitější modely) vylučování, kinetický bioakumulační faktor (BAFK) a, je-li to možné, intervaly spolehlivosti každého z těchto parametrů se vypočítají z modelových rovnic za použití počítače (návod viz dodatek 2). Oprávněnost jakéhokoli modelu lze určit např. z korelačního koeficientu nebo z koeficientu determinace (koeficienty, jejichž hodnota se blíží jedné, indikují oprávněnost), nebo na základě druhé mocniny chí (χ2). Také velikost standardní odchylky nebo intervalu spolehlivosti kolem odhadovaných parametrů mohou svědčit o oprávněnosti modelu.
|
|
16.
|
Ke snížení rozptylu výsledků zkoušek pro zkoušené chemické látky s vysokou lipofilností by měly být bioakumulační faktory vyjádřeny ve vztahu k obsahu lipidů a obsahu organického uhlíku (kg organického uhlíku v půdě (OC) na kg lipidů v červech). Tento přístup je založen na skutečnosti, že u některých skupin chemických látek existuje jasný vztah mezi potenciálem bioakumulace a lipofilností, což je široce používáno v případě ryb (47). Existuje vztah mezi obsahem lipidů v rybách a bioakumulací těchto chemických látek. U bentických organismů byly zjištěny podobné korelace např. (30, 44). Obdobně byla tato korelace prokázána u terestrických máloštětinatců, např. (5, 6, 7, 14). Pokud je k dispozici dostatečné množství tkání červů, lze stanovit obsah lipidů u pokusných živočichů na stejném biologickém materiálu, který byl použit ke stanovení koncentrace zkoušené chemické látky. Ke stanovení obsahu lipidů lze použít rovněž kontrolní živočichy.
|
PLATNOST ZKOUŠKY
|
17.
|
Má-li být zkouška platná, musí být při kontrole i expozici splněny následující podmínky:
|
—
|
Celková úmrtnost ve fázi příjmu a ve fázi vyprázdnění nesmí na konci zkoušky překročit 10 % (žížaly) nebo 20 % (roupice) z celkového počtu vložených červů.
|
|
—
|
Průměrná ztráta hmotnosti u Eisenia fetida a Eisenia andrei měřená na konci fáze příjmu a na konci fáze vylučování by neměla přesáhnout 20 % v porovnání s původní čerstvou hmotností (f.w.) na začátku každé fáze.
|
|
POPIS METODY
Testovací druh
|
18.
|
Pro zkoušky bioakumulace se doporučuje používat několik druhů terestrických máloštětinatců. Nejběžněji používané druhy Eisenia fetida nebo Eisenia Andrei (Lumbricidae) nebo Enchytraeus albidus, Enchytraeus crypticus, nebo Enchytraeus luxuriosus (Enchytraeidae)) jsou popsány v dodatku 5.
|
Přístroje a pomůcky
|
19.
|
U všech částí zařízení je třeba se vyhýbat použití materiálů, které se mohou rozpouštět, adsorbovat zkoušenou chemickou látku nebo vyluhovat jiné chemické látky a mají nepříznivý účinek na pokusné živočichy. Lze použít standardní pravoúhlé nebo válcové nádrže vyrobené z chemicky inertního materiálu a mající vhodný objem s ohledem na náplň, tj. počet zkušebních červů. Veškeré vybavení, které se dostane do styku se zkušebním médiem, může být vyrobeno z korozivzdorné oceli, plastu nebo skla. Zkušební nádoby by měly být vhodným způsobem zakryty, aby se zabránilo úniku červů, přičemž je nutné zajistit dostatečný přívod vzduchu. Pro látky s vysokými adsorpčními koeficienty, jako jsou syntetické pyrethroidy, může být nutné použít silanizované sklo. V těchto případech musí být zařízení po použití zlikvidováno (49). U radioaktivně značených zkoušených látek a těkavých chemických látek je nutné zabránit jejich úniku. Je nutno použít lapače (např. skleněné promývačky plynu) obsahující vhodný absorbent schopný udržet zbytky odpařující se ze zkušebních nádob.
|
Půda
|
20.
|
Zkušební půda by měla mít takovou kvalitu, která umožní přežití zkušebních organismů, a pokud možno jejich reprodukci po dobu aklimatizace a v průběhu fází zkoušky, aniž by vykazovaly abnormální vzhled nebo chování. Červi by se měli zavrtat do půdy.
|
|
21.
|
Jako zkušební substrát se doporučuje užít umělou půdu popsanou v kapitole C.8 této přílohy (48). Příprava umělé půdy pro použití při zkouškách bioakumulace a doporučení pro skladování umělé půdy jsou uvedeny v příloze 4. Umělou půdu vysušenou na vzduchu lze uchovávat při pokojové teplotě až do použití.
|
|
22.
|
Jako zkušební a/nebo kultivační půdu však lze použít i přírodní půdu z neznečištěných lokalit. Přírodní půdy by měly být charakterizovány alespoň podle původu (místa odběru), pH, obsahu organického uhlíku, distribuce částic (procento písku, prachu a jílu), maximální vodní kapacity (WHCmax) a procenta obsahu vody (3). Užitečné informace by měla poskytnout analýza půdy nebo jejích složek na mikroskopické znečišťující látky před použitím. Pokud se využívá zemědělská půda z pole, neměla by být ošetřena přípravky na ochranu rostlin ani hnojem od exponovaných zvířat jako hnojivem po dobu nejméně jednoho roku a organickými hnojivy po dobu nejméně šesti měsíců před odběrem vzorku (50). Postupy manipulace s přírodními půdami před použitím při ekotoxikologických laboratorních zkouškách na máloštětinatcích jsou popsány v bodě (3). U přírodní půdy by doba skladování v laboratoři měla být co nejkratší.
|
Aplikace zkoušené chemické látky
|
23.
|
Zkoušená chemická látka se přidá do půdy. Měly by být vzaty v úvahu fyzikálně-chemické vlastnosti zkoušené chemické látky. Ve vodě rozpustná zkoušená chemická látka by měla být před smísením s půdou zcela rozpuštěna ve vodě. Doporučený postup vmíchávání těžko rozpustných zkoušených chemických látek zahrnuje obalení jedné nebo více složek (umělé) půdy zkoušenou chemickou látkou. Například křemenný písek nebo jeho část se ponoří do roztoku zkoušené chemické látky ve vhodném organickém rozpouštědle, které se pak pomalu odpaří do sucha. Obalenou frakci lze následně promíchat s vlhkou půdou. Hlavní výhodou tohoto postupu je, že se do půdy nevpravují žádná rozpouštědla. Je-li použita přírodní půda, lze zkoušenou chemickou látku přidat vmícháním části půdy vysušené na vzduchu, jak bylo popsáno výše u umělé půdy, nebo vmícháním zkoušené chemické látky do vlhké půdy s následným odpařováním, pokud bylo použito solubilizační činidlo. Obecně platí, že je třeba pokud možno se vyhnout kontaktu vlhké půdy s rozpouštědly. Je třeba zvážit následující skutečnosti (3):
|
—
|
Užije-li se jiné rozpouštědlo než voda, mělo by být takové, aby bylo mísitelné s vodou a/nebo odbouratelné (například odpařením) tak, že v půdě zůstane jen zkoušená chemická látka.
|
|
—
|
Použije-li se kontrola rozpouštědla, není nutno provést negativní kontrolu. Kontrola rozpouštědla by měla obsahovat nejvyšší koncentraci rozpouštědla přidávaného do půdy a mělo by při ní být užito rozpouštědla ze stejné šarže, která byla použita pro zásobní roztok. Hlavním kritériem pro výběr vhodného solubilizačního činidla by měla být toxicita a těkavost rozpouštědla a rozpustnost zkoušené látky ve zvoleném rozpouštědle.
|
|
|
24.
|
Pro chemické látky, které jsou obtížně rozpustné ve vodě a v organických rozpouštědlech, lze smísit 2,0–2,5 g jemně rozemletého křemenného písku na zkušební nádobu, např. pomocí třecí misky a tloučku s takovým množstvím zkoušené látky, aby bylo dosaženo požadované zkušební koncentrace. Tato směs křemenného písku a zkoušené chemické látky se přidá do navlhčené půdy a důkladně se promíchá s příslušným množstvím deionizované vody, aby bylo dosaženo požadované vlhkosti. Konečná směs se rozdělí do zkušebních nádob. Tento postup se opakuje pro každou zkušební koncentraci a připraví se také příslušná kontrola s 2,0–2,5 g jemně rozemletého křemenného písku na zkušební nádobu.
|
|
25.
|
Po vmíchání by měla být stanovena koncentrace zkoušené látky v půdě. Před vložením zkušebních organismů je třeba ověřit homogenní distribuci zkoušené chemické látky v půdě. Měla by být uvedena metoda vmíchání a důvody pro výběr konkrétní metody vmíchání (24).
|
|
26.
|
Rovnováha mezi půdou a fází kapilární vody by měla být v ideálním případě nastolena před přidáním organismů; doporučuje se doba čtyř dnů při teplotě 20 °C. Pro řadu organických chemických látek těžko rozpustných ve vodě se doba potřebná k dosažení skutečné rovnováhy mezi adsorbovanou a rozpuštěnou frakcí počítá ve dnech nebo v měsících. V závislosti na účelu studie, například když je potřeba napodobit podmínky okolního prostředí, může obohacená půda „zrát“ i déle, například u kovů po dobu tří týdnů při teplotě 20 °C (22).
|
Kultivace zkušebních organismů
|
27.
|
Červi by měli být v optimálním případě nepřetržitě udržováni v laboratorních podmínkách. Pokyny týkající se metod laboratorní kultury pro Eisenia fetida, Eisenia Andrei a roupice jsou uvedeny v příloze 5 (viz také (48, 51, 52)).
|
|
28.
|
Červi použití při zkouškách nesmí vykazovat pozorovatelné nemoci, abnormality a parazity.
|
PROVEDENÍ ZKOUŠKY
|
29.
|
Zkušební organismy se exponují zkoušené látce během fáze příjmu. Fáze příjmu by měla trvat 14 dnů (roupice) nebo 21 dnů (žížaly), pokud není prokázáno, že bylo dosaženo ustáleného stavu.
|
|
30.
|
Ve fázi vylučování se červi přenesou do půdy bez zkoušené látky. První vzorek by měl být odebrán 4–24 hodin po zahájení fáze vylučování. Příklady harmonogramů odběru vzorků pro jedenadvacetidenní fázi příjmu a jedenadvacetidenní fázi vylučování jsou uvedeny v dodatku 3.
|
Zkušební organismy
|
31.
|
Řada druhů terestrických roupic má jen velmi nízkou individuální hmotnost (např. 5–10 mg hmotnosti ve vlhkém stavu na jedince u Enchytraeus albidus a ještě méně u Enchytraeus crypticus či Enchytraeus luxuriosus); aby bylo možné provést vážení a chemickou analýzu, může být nezbytné sdružovat červy v paralelních zkušebních nádobách (tj. k získání jednoho analytického výsledku tkáně se použijí všichni červi v paralelní nádobě). Do každé paralelní nádoby se vloží 20 jednotlivých roupic a použijí se nejméně tři paralelní nádoby. V případě, že jsou meze stanovitelnosti zkoušené látky příliš vysoké, může být potřeba více červů. U zkušebních druhů s vyšší individuální hmotnosti (Eisenia fetida a Eisenia Andrei) lze použít paralelní nádoby obsahující pouze jednoho jedince.
|
|
32.
|
Žížaly použité ke zkoušce by měly mít podobnou hmotnost (např. Eisenia fetida a Eisenia Andrei by měly mít individuální hmotnost 250–600 mg). Roupice např. Enchytraeus albidus) by měly být přibližně 1 cm dlouhé. Všichni červi užití pro konkrétní zkoušku musí pocházet ze stejného zdroje a mělo by se jednat o dospělé jedince s opaskem (viz příloha 5). Vzhledem k tomu, že hmotnost a stáří živočicha může mít vliv na hodnoty BAF (např. z důvodu různého obsahu lipidů a/nebo přítomnosti vajíček), měly by být tyto parametry přesně zaznamenány a zohledněny při interpretaci výsledků. Kromě toho mohou být v průběhu doby expozice vyprodukovány kokony, což rovněž ovlivní hodnoty BAF. Doporučuje se zvážit před zkouškou dílčí vzorek zkoušených červů s cílem odhadnout střední hmotnost ve vlhkém a v suchém stavu.
|
|
33.
|
Volí se vysoký poměr množství půdy k počtu červů, aby se minimalizovalo snížení koncentrace zkoušené chemické látky v půdě v průběhu fáze příjmu. V případě Eisenia fetida a Eisenia Andrei se doporučuje minimální množství 50 g suché hmotnosti (d.w.) půdy na jednoho červa a v případě roupic minimálně 10–20 g suché hmotnosti půdy na zkušební nádobu. Nádoby by měly obsahovat vrstvu půdy o tloušťce 2–3 cm (roupice) nebo 4–5 cm (žížaly).
|
|
34.
|
Červi použití ke zkoušce se vyjmou z kultury (např. roupice pomocí klenotnické pinzety). Dospělí jedinci se přenesou na neexponovanou zkušební půdu za účelem aklimatizace a krmí se (viz odstavec 36). V případě, že se zkušební podmínky liší od kultivačních podmínek, měla by pro přizpůsobení červů zkušebním podmínkám postačovat aklimatizační fáze v trvání 24 až 72 hodin. Po aklimatizaci se žížaly omyjí přenesením do skleněných misek (např. Petriho misek), které obsahují čistou vodu, a následně se před přidáním do zkušební půdy zváží. Před zvážením se z červů odstraní přebytečná voda jemným oklepáním o okraj misky nebo opatrným osušením do sucha pomocí lehce navlhčeného papírového ručníku.
|
|
35.
|
Zavrtávání zkušebních organismů by mělo být sledováno a zaznamenáváno. Při zkouškách s žížalami se jedinci (v kontrolních i exponovaných nádobách), běžně zavrtají do půdy do několika hodin; tuto skutečnost je nutno zkontrolovat nejpozději do 24 hodin po vložení červů do zkušebních nádob. V případě, že se žížaly nezavrtají do půdy (např. více než 10 % v době přesahující polovinu fáze příjmu), znamená to, že buď nejsou vytvořeny vhodné zkušební podmínky, nebo zkušební organismy nejsou zdravé. V takovém případě je nutno zkoušku ukončit a opakovat. Roupice žijí hlavně v intersticiálních pórech v půdě a jejich integument je často v kontaktu s okolním substrátem jen částečně; expozice zavrtávajících se a nezavrtávajících se roupic se považuje za rovnocennou a nezavrtávání roupic nemusí nutně vyžadovat opakování zkoušky.
|
Krmení
|
36.
|
Krmení by se mělo předpokládat při použití půdy s nízkým celkovým obsahem organického uhlíku. Při použití umělé půdy se doporučuje týdenní frekvence krmení (tj. červi by měli být krmeni jednou týdně) 7 mg sušeného hnoje na gram suché hmotnosti půdy pro žížaly a týdenní frekvence 2–2,5 mg mletých ovesných vloček na gram suché hmotnosti půdy pro roupice (11). První krmná dávka se smíchá s půdou bezprostředně před přidáním zkušebních organismů. Optimálně by měl být užíván stejný typ krmiva jako v kulturách (viz dodatek 5).
|
Světlo a teplota
|
37.
|
Zkouška se provede za řízených světelných podmínek v prostorách, kde jsou umístěny zkušební nádoby, nejlépe 16 h světlo / 8 h tma, optimálně při intenzitě osvětlení 400 lux až 800 lux (3). Zkušební teplota by se měla udržovat na 20 ± 2 °C po celou dobu zkoušky.
|
Zkušební koncentrace
|
38.
|
Použije se jedna koncentrace. Situace, kdy je vyžadována (jsou vyžadovány) další koncentrace, by měly být zdůvodněny. Pokud se toxicita (ECx) zkoušené chemické látky blíží mezi detekce analytické metody, doporučuje se užití zkoušené látky značené radioizotopy s vysokou specifickou radioaktivitou. Pro kovy by její koncentrace měla být vyšší než koncentrace v pozadí ve tkáních a v půdě.
|
Paralelní vzorky
|
39.
|
Pro kinetická měření (ve fázi příjmu a vylučování) je minimální počet exponovaných paralelních nádob tři na jeden odběr. Celkový počet připravených paralelních nádob by měl být dostatečný k pokrytí všech odběrů ve fázi příjmu i vylučování.
|
|
40.
|
Pro biologická pozorování a měření (např. poměr hmotnosti ve vlhkém stavu a suché hmotnosti, obsah lipidů) a pro analýzu koncentrací v pozadí v červech a půdě je zapotřebí nejméně 12 paralelních nádob negativních kontrol (čtyři vzorky odebrané na začátku a čtyři na konci fáze příjmu a čtyři na konci fáze vylučování) v případě, že není použito jiné rozpouštědlo než voda. Pokud bylo pro aplikaci zkoušené chemické látky užito jakékoli solubilizační činidlo, měly by být kromě exponovaných paralelních nádob připraveny i kontroly rozpouštědla (ze čtyř paralelních nádob by měly být odebrány vzorky na začátku, ze čtyř na konci fáze příjmu a ze čtyř na konci fáze vylučování), které budou obsahovat všechny složky s výjimkou zkoušené látky. V tomto případě je možno použít další čtyři paralelní nádoby jako negativní kontroly (bez rozpouštědla) za účelem volitelného odběru vzorků na konci fáze příjmu. Tyto paralelní nádoby lze biologicky srovnat s kontrolou rozpouštědla s cílem získat informace o možném vlivu rozpouštědla na zkušební organismy. Doporučuje se použít dostatečný počet dalších rezervních paralelních nádob (např. osm) pro expozici a kontrolu.
|
Četnost měření kvality půdy
|
41.
|
Na počátku a na konci fáze příjmu a fáze vyprázdnění se změří pH půdy, vlhkost půdy a teplota (kontinuálně) ve zkušební místnosti. Jednou týdně by se měla kontrolovat vlhkost půdy zvážením zkušebních nádob a porovnáním jejich skutečné hmotnosti s počáteční hmotností na začátku zkoušky. Ztráty vody by měly být kompenzovány přidáním deionizované vody.
|
Odběr vzorků a analýza červů a půdy
|
42.
|
Příklad harmonogramu fází příjmu a vylučování u bioakumulačních zkoušek na žížalách a roupicích je uveden v dodatku 3.
|
|
43.
|
Vzorky půdy ze zkušebních nádob pro stanovení koncentrace zkoušené chemické látky se odebírají před vložením červů, během fáze příjmu a během fáze vylučování. Během zkoušky se stanoví koncentrace zkoušené chemické látky v červech a v půdě. Obecně platí, že se měří celkové koncentrace v půdě. Nepovinně lze měřit koncentrace v kapilární vodě, a v takovém případě je před zahájením studie nutno uvést zdůvodnění a vhodné metody, které jsou zahrnuty také do zprávy.
|
|
44.
|
Vzorky z červů a půdy se odebírají nejméně šestkrát během fáze příjmu a fáze vylučování. V případě, že se prokáže stabilita zkoušené chemické látky, lze počet analýz půdy snížit. Doporučuje se analyzovat nejméně tři paralelní vzorky na začátku a na konci fáze příjmu. V případě, že se koncentrace v půdě měřená na konci fáze příjmu liší od počáteční koncentrace o více než 30 %, měly by být analyzovány i vzorky půdy odebrané v jiných termínech.
|
|
45.
|
Červi v dané paralelní nádobě se vyjmou z půdy při každém odběru (např. rozprostřením půdy z paralelní nádoby na mělkou podložku a vyjmutím červů pomocí měkké klenotnické pinzety) a rychle se opláchnou vodou na mělké skleněné nebo ocelové podložce. Odstraní se přebytečná voda (viz bod 34). Červi se opatrně přenesou do předem zvážené nádoby a okamžitě se zváží, včetně střevního obsahu.
|
|
46.
|
Žížalám (Eisenia sp.) by pak mělo být umožněno přes noc vyprázdnit střeva např. na vlhkém filtračním papíru v přikryté Petriho misce (viz bod 34). Po vyprázdnění by měla být stanovena hmotnost červů za účelem posouzení možného úbytku biomasy během zkoušky (viz kritéria platnosti v bodě 17). Vážení a analýza tkání u roupic se provádí bez vyprázdnění, které by bylo technicky obtížné vzhledem k malé velikosti těchto červů. Po konečném určení hmotnosti by měli být červi okamžitě usmrceni nejvhodnější metodou (např. pomocí tekutého dusíku nebo zmrazením při teplotách pod –18 °C).
|
|
47.
|
V průběhu fáze vylučování nahradí červi kontaminovaný střevní obsah čistou zeminou. To znamená, že měření u nevyprázdněných červů (v tomto kontextu roupic), kde byly odebrány vzorky bezprostředně před fází vylučování, obsahují kontaminovanou půdu ze střeva. U vodních máloštětinatců se předpokládá, že po počátečních 4–24 hodinách vylučovací fáze je již většina kontaminovaného obsahu střeva nahrazena čistým sedimentem, např. (46). Obdobné výsledky jsou uváděny u žížal v případě studií o hromadění radioaktivně značeného kadmia a zinku (78). U nevyprázdněných roupic lze koncentraci tohoto prvního vzorku vylučovací fáze považovat za koncentraci v tkáni po vyprázdnění střeva. Pro zohlednění naředění koncentrace zkoušené látky nekontaminovanou půdou v průběhu fáze vylučování lze odhadnout hmotnost střevního obsahu z poměru hmotnosti červa ve vlhkém stavu a hmotnosti popela po spálení červa, případně z poměru suché hmotnosti červa a hmotnosti popela po spálení červa.
|
|
48.
|
Vzorky půdy a červů se pokud možno analyzují ihned po vyjmutí (tj. do 1–2 dnů) s cílem předejít rozkladu nebo jiným ztrátám a výpočet přibližné rychlosti příjmu a vylučování se doporučuje provést ještě v průběhu zkoušky. Neprovede-li se analýza okamžitě, vzorky se vhodným způsobem uchovají, např. hlubokým zmrazením (≤ –18 °C).
|
|
49.
|
Je třeba zkontrolovat, že přesnost a reprodukovatelnost chemické analýzy a rovněž výtěžek zkoušené látky jak z půdy, tak ze vzorků červů jsou pro danou analytickou metodu dostatečné; uvádí se rovněž účinnost extrakce, mez detekce (LOD) a mez kvantifikace (LOQ). Stejně tak je třeba zkontrolovat, zda se zkoušená chemická látka nevyskytuje v kontrolních nádobách v koncentracích vyšších než koncentrace v pozadí. Pokud je koncentrace zkoušené chemické látky ve zkušebním organismu u kontrolní skupiny červů Ca > 0, měla by být zahrnuta do výpočtu kinetických parametrů (viz dodatek 2). Všechny vzorky by měly být v průběhu celé zkoušky zpracovávány tak, aby se minimalizovala kontaminace a ztráty (např. v důsledku adsorpce zkoušené chemické látky odběrným zařízením).
|
|
50.
|
Jsou-li použity zkušební chemické látky značené radioizotopy, je možné provést analýzu pro výchozí látku i s metabolity. Kvantifikace výchozí zkušební chemické látky a metabolitů v ustáleném stavu nebo na konci fáze příjmu poskytuje důležité informace. Následně by měla být provedena separace, aby mohla být výchozí látka analyzována samostatně. Pokud obsah radioaktivity v jednotlivých metabolitech přesáhne 10 % celkové radioaktivity v analyzovaném vzorku (vzorcích), doporučuje se stanovit i tyto metabolity.
|
|
51.
|
Měl by být zaznamenán a hlášen celkový vývin a vývin zkoušené látky v červech, v půdě a případně i v lapačích obsahujících absorbenty k zachycení odpařené zkoušené chemické látky.
|
|
52.
|
U roupic, které jsou menší než žížaly, je přijatelné sdružování jedinců odebraných jako vzorek z dané zkušební nádoby. Pokud sdružování znamená redukci počtu paralelních nádob, omezuje to statistické postupy, které lze na údaje aplikovat. Pokud je vyžadován určitý statistický postup a statistická váha, měl by být ve zkoušce nasazen přiměřený počet paralelních zkušebních nádob vyhovující požadovanému sdružování, postupu a statistické váze.
|
|
53.
|
Doporučuje se, aby byla hodnota BAF vyjádřena jako funkce celkové suché hmotnosti, a bude-li to vyžadováno (např. u vysoce hydrofobních chemických látek), také jako funkce obsahu lipidů. Pro stanovení obsahu lipidů by měla být použita vhodná metoda (pro tento účel by měly být přizpůsobeny některé již existující metody – např. (31), (58). yto metody využívají extrakci pomocí chloroformu/methanolu. Aby se zabránilo používání chlorovaných rozpouštědel, měla by však být použita modifikace Bligh/Dyerovy metody (9) uvedené v odstavci (17). Vzhledem k tomu, že různé metody nemusí poskytovat stejné hodnoty (10), je důležité uvést podrobnosti o použité metodě. Je-li to možné, tj. pokud je k dispozici dostatečné množství tkáně červů, měla by být analýza lipidů provedena optimálně na stejném vzorku extraktu, který byl užit pro analýzu zkoušené chemické látky, neboť lipidy musí být často z extraktu před chromatografickou analýzou odstraněny. Pro stanovení obsahu lipidů lze použít rovněž kontrolní živočichy a tento obsah lze pak použít k normalizaci hodnot BAF. Tento druhý postup snižuje kontaminaci zařízení zkoušenou chemickou látkou.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Zpracování výsledků
|
54.
|
Křivka příjmu zkoušené látky se sestrojí vynesením její koncentrace v červech nebo na nich v průběhu fáze příjmu proti času v lineárním měřítku. Dosáhla-li křivka fáze plató čili ustáleného stavu (viz definice v dodatku 1), vypočítá se hodnota bioakumulačního faktoru v ustáleném stavu BAFSS z poměru:

Ca je koncentrace zkoušené chemické látky ve zkušebním organismu,
Cs je koncentrace zkoušené chemické látky v půdě.
|
|
55.
|
Není-li dosaženo ustáleného stavu, měla by být místo hodnoty BAFSS vypočtena hodnota BAFK na základě rychlostních konstant, jak je popsáno níže:
|
—
|
Stanoví se akumulační faktor (BAFK) jako poměr ks/ke.
|
|
—
|
Rychlost příjmu a vylučování se optimálně vypočtou současně (viz rovnice 11 v dodatku 2).
|
|
—
|
Rychlostní konstanta vylučování (ke) se obvykle stanoví z křivky vylučování (tj. grafu poklesu koncentrace zkoušené chemické látky v červech v průběhu fáze vylučování). Následně se vypočte rychlostní konstanta příjmu pomocí hodnoty ke a hodnoty Ca, odvozené z křivky příjmu (popis těchto metod viz dodatek 2). Upřednostňovanou metodou pro získání hodnoty BAFK a rychlostních konstant ks a ke je metoda nelineárního odhadu parametrů s využitím počítače. Není-li zjevně křivka vylučování křivkou prvního řádu, měly by být použity složitější modely.
|
|
Protokol o zkoušce
|
56.
|
Protokol o zkoušce by měl obsahovat tyto informace:
|
|
Zkoušená látka:
|
—
|
veškeré dostupné informace o akutní nebo dlouhodobé toxicitě (např. ECx, LCx“ NOEC) zkoušené chemické látky pro půdní máloštětinatce,
|
|
—
|
čistotu, fyzikální povahu a fyzikálně-chemické vlastnosti, např. log Kow, rozpustnost ve vodě,
|
|
—
|
chemické identifikační údaje; zdroj zkoušené položky, identifikaci a koncentraci případného použitého rozpouštědla,
|
|
—
|
v případě značení radioaktivními izotopy jejich přesnou polohu, specifickou radioaktivitu a radiochemickou čistotu.
|
|
|
|
Testovací druh:
|
—
|
vědecký název, kmen, zdroj, případné předběžné ošetření, aklimatizace, stáří, rozmezí velikostí atd.
|
|
|
|
Zkušební podmínky:
|
—
|
použitý zkušební postup,
|
|
—
|
typ a charakteristiky použitého osvětlení a fotoperioda (fotoperiody),
|
|
—
|
uspořádání zkoušky (např. počet a velikost zkušebních nádob, hmotnost půdy a tloušťka půdní vrstvy, počet paralelních nádob, počet červů v jedné paralelní nádobě, počet zkušebních koncentrací, délka fází příjmu a vylučování, četnost odběru vzorků),
|
|
—
|
zdůvodnění výběru materiálu zkušební nádoby,
|
|
—
|
metoda přípravy a aplikace zkoušené položky a důvody pro výběr konkrétní metody,
|
|
—
|
nominální zkušební koncentrace, střední hodnoty naměřených koncentrací ve zkušebních nádobách, jejich směrodatné odchylky a metody, jimiž byly tyto hodnoty získány,
|
|
—
|
zdroj složek umělé půdy nebo – v případě užití přírodního média – původ půdy, popis jakékoli předchozí úpravy, výsledky kontrol (přežití, vývoj biomasy, reprodukce), charakteristika půdy, (pH, obsah celkového organického uhlíku, distribuce částic (procento písku, prachu a jílu), procento obsahu vody WHCmax na začátku a na konci zkoušky a jiná provedená měření),
|
|
—
|
podrobné informace o expozici vzorků půdy a červů včetně podrobností o přípravě, uchovávání, postupech vmíchávání, extrakci a analytických postupech (a přesnosti), pokud jde o zkoušenou látku v červech a půdě, obsah lipidů (je-li měřen) a výtěžky zkoušené položky.
|
|
|
|
Výsledky:
|
—
|
úhyn kontrolních červů a červů v každé zkušební nádobě a jakékoli pozorované neobvyklé chování (např. snaha uniknout z půdy, nerozmnožování v bioakumulačních zkouškách na roupicích),
|
|
—
|
poměr suché hmotnosti půdy a zkušebních organismů k jejich hmotnosti ve vlhkém stavu (užitečné pro normalizaci),
|
|
—
|
hmotnost červů ve vlhkém stavu při každém odběru; u žížal vlhká hmotnost na začátku zkoušky a po každém odběru před pročištěním střev a po něm,
|
|
—
|
obsah lipidů ve zkoušených organismech (je-li stanoven),
|
|
—
|
křivky kinetiky příjmu a vylučování zkoušené chemické látky červy a doba dosažení ustáleného stavu,
|
|
—
|
hodnoty Ca a Cs (popřípadě se směrodatnými odchylkami a rozpětím) pro všechny odběry (hodnota Ca se vyjadřuje v g/kg vlhké a suché hmotnosti celého těla, hodnota Cs se vyjadřuje v g/kg vlhké a suché hmotnosti půdy). Pokud je vyžadován akumulační faktor biota-půda (BSAF) (například pro porovnání výsledků dvou nebo více zkoušek provedených s živočichy s odlišným obsahem lipidů), lze navíc vyjádřit i hodnotu Ca jako g/kg obsahu lipidů v organismu a hodnotu Cs jako g/kg organického uhlíku (OC) v půdě.
|
|
—
|
dodatečně lze uvést i BAF (vyjádřený v kg půdy na·kg červů), rychlostní konstantu příjmu půdy ks (vyjádřenou v g půdy na kg červů za den) a rychlostní konstantu vylučování ke (vyjádřenou v číselné hodnotě za den); BSAF (vyjádřený v kg organického půdního uhlíku na kg obsahu lipidů v červech),
|
|
—
|
měří-li se, procentuální podíl výchozí chemické látky, metabolitů a vázaných reziduí (tj. procentní podíl zkoušené chemické látky, který nelze extrahovat běžnými metodami extrakce) zjištěný v půdě a ve zkoušených živočiších,
|
|
—
|
metody užívané pro statistické analýzy dat.
|
|
|
|
Vyhodnocení výsledků
|
—
|
soulad výsledků s kritérii validity uvedenými v odstavci 17,
|
|
—
|
neočekávané nebo neobvyklé výsledky, např. neúplné odstranění zkoušené látky z pokusných zvířat.
|
|
|
LITERATURA:
|
1)
|
Amorim M (2000). Chronic and toxicokinetic behavior of Lindane (γ-HCH) in the Enchytraeid Enchytraeus albidus. Master thesis, University Coimbra.
|
|
2)
|
ASTM (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates. American Society for Testing and Materials, E 1688-00a.
|
|
3)
|
ASTM International (2004). Standard guide for conducting laboratory soil toxicity or bioaccumulation tests with the Lumbricid earthworm Eisenia fetida and the Enchytraeid potworm Enchytraeus albidus. ASTM International, E1676-04: 26 pp.
|
|
4)
|
Beek B, Boehling S, Bruckmann U, Franke C, Joehncke U, Studinger G (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation - New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235–276.
|
|
5)
|
Belfroid A, Sikkenk M, Seinen W, Van Gestel C, Hermens J (1994). The toxicokinetic behavior of chlorobenzenes in earthworms (Eisenia andrei): Experiments in soil. Environ. Toxicol. Chem. 13: 93–99.
|
|
6)
|
Belfroid A, Van Wezel A, Sikkenk M, Van Gestel C, Seinen W & Hermens J (1993). The toxicokinetic behavior of chlorobenzenes in earthworms (Eisenia andrei): Experiments in water. Ecotox. Environ. Safety 25: 154–165.
|
|
7)
|
Belfroid A, Meiling J, Drenth H, Hermens J, Seinen W, Van Gestel C (1995). Dietary uptake of superlipophilic compounds by earthworms (Eisenia andrei). Ecotox. Environ. Safety 31: 185–191.
|
|
8)
|
Bell AW (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902: 1–13.
|
|
9)
|
Bligh EG and Dyer WJ (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Pysiol. 37: 911–917.
|
|
10)
|
Bouche M (1972). Lombriciens de France. Ecologie et Systematique. INRA, Annales de Zoologie-Ecologie animale, Paris, 671 p.
|
|
11)
|
Bruns E, Egeler Ph, Moser T, Römbke J, Scheffczyk A, Spörlein P (2001a). Standardisierung und Validierung eines Bioakkumulationstests mit terrestrischen Oligochaeten. Report to the German Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 298 64 416.
|
|
12)
|
Bruns E, Egeler Ph, Römbke J Scheffczyk A, Spörlein P (2001b). Bioaccumulation of lindane and hexachlorobenzene by the oligochaetes Enchytraeus luxuriosus and Enchytraeus albidus (Enchytraeidae, Oligochaeta, Annelida). Hydrobiologia 463: 185–196.
|
|
13)
|
Conder JM and Lanno RP (2003). Lethal critical body residues as measures of Cd, Pb, and Zn bioavailability and toxicity in the earthworm Eisenia fetida. J. Soils Sediments 3: 13–20.
|
|
14)
|
Connell DW and Markwell RD (1990). Bioaccumulation in the Soil to Earthworm System. Chemosphere 20: 91–100.
|
|
15)
|
Didden WAM (1993). Ecology of Terrestrial Enchytraeidae. Pedobiologia 37: 2-29.
|
|
16)
|
Didden W (2003). Oligochaeta, In: Bioindicators and biomonitors. Markert, B.A., Breure, A.M. & Zechmeister, H.G. (eds.). Elsevier Science Ltd., The Netherlands, pp. 555–576.
|
|
17)
|
De Boer J, Smedes F, Wells D, Allan A (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2, Exercise 1000, EU, Standards, Measurement and Testing Programme.
|
|
18)
|
Dietrich DR, Schmid P, Zweifel U, Schlatter C, Jenni-Eiermann S, Bachmann H, Bühler U, Zbinden N (1995). Mortality of birds of prey following field application of granular carbofuran: A Case Study. Arch. Environ. Contam. Toxicol. 29: 140–145.
|
|
19)
|
Nařízení Evropského parlamentu a Rady (ES) č. 1907/2006 ze dne 18. prosince 2006 o registraci, hodnocení, povolování a omezování chemických látek, o zřízení Evropské agentury pro chemické látky, o změně směrnice 1999/45/ES a o zrušení nařízení Rady (EHS) č. 793/93, nařízení Komise (ES) č. 1488/94, směrnice Rady 76/769/EHS a směrnic Komise 91/155/EHS, 93/67/EHS, 93/105/ES a 2000/21/ES, Úř. věst. L 396, 30.12.2006, s. 1.
|
|
20)
|
Edwards CA and Bohlen PJ (1996). Biology and ecology of earthworms. Third Edition, Chapman & Hall, London, 426 pp.
|
|
21)
|
OECD (2008), Bioaccumulation in Sediment-dwelling Benthic Oligochates, Test Guideline No. 315, Guidelines for the testing of chemicals, OECD, Paris.
|
|
22)
|
Egeler Ph, Gilberg D, Scheffczyk A, Moser Th and Römbke J (2009). Validation of a Soil Bioaccumulation Test with Terrestrial Oligochaetes by an International Ring Test (Validierung einer Methode zur standardisierten Messung der Bioakkumulation mit terrestrischen Oligochaeten). Report to the Federal Environmental Agency (Umweltbundesamt Dessau-Rosslau), R&D No.: 204 67 458: 149 pp. Ke stažení na adrese: http://www.oecd.org/dataoecd/12/20/42552727.pdf.
|
|
23)
|
Elmegaard N and Jagers op Akkerhuis GAJM (2000). Safety factors in pesticide risk assessment, Differences in species sensitivity and acute-chronic relations. National Environmental Research Institute, NERI Technical Report 325: 57 pp.
|
|
24)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
25)
|
EPPO (2003). Environmental Risk Assessment scheme for plant protection products. Soil organisms and functions, EPPO (European Plant Protection Organization) Standards, Bull, OEPP/EPPO 33: 195–208.
|
|
26)
|
Franke C (1996). How meaningful is the bioconcentration factor for risk assessment? Chemosphere 32: 1897–1905.
|
|
27)
|
Franke C, Studinger G, Berger G, Böhling S, Bruckmann U, Cohors-Fresenborg D, Jöhncke U (1994). The assessment of bioaccumulation. Chemosphere 29: 1501–1514.
|
|
28)
|
Füll C (1996). Bioakkumulation und Metabolismus von -1,2,3,4,5,6-Hexachlorcyclohexan (Lindan) und 2-(2,4-Dichlorphenoxy)-propionsäure (Dichlorprop) beim Regenwurm Lumbricus rubellus (Oligochaeta, Lumbricidae). Dissertation University Mainz, 156 pp.
|
|
29)
|
Füll C, Schulte C, Kula C (2003). Bewertung der Auswirkungen von Pflanzenschutzmitteln auf Regenwürmer. UWSF - Z. Umweltchem, Ökotox. 15: 78–84.
|
|
30)
|
Gabric A.J, Connell DW, Bell PRF (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24: 1225–1231.
|
|
31)
|
Gardner WS, Frez WA, Cichocki EA, Parrish CC (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography 30: 1099–1105.
|
|
32)
|
Hawker DW and Connell DW (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22: 701–707.
|
|
33)
|
Hund-Rinke K and Wiechering H (2000). Earthworm avoidance test for soil assessments: An alternative for acute and reproduction tests. J. Soils Sediments 1: 15–20.
|
|
34)
|
Hund-Rinke K, Römbke J, Riepert F, Achazi R (2000). Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.), Spektrum Verl., Heidelberg, 59–81.
|
|
35)
|
ISO 11268-2 (1998) Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction.
|
|
36)
|
Jaenike J (1982). „Eisenia foetida“ is two biological species. Megadrilogica 4: 6–8.
|
|
37)
|
Jager T (1998). Mechanistic approach for estimating bioconcentration of organic chemicals in earthworms (Oligochaeta). Environ. Toxicol. Chem. 17: 2080–2090.
|
|
38)
|
Jager T, Sanchez PA, Muijs B, van der Welde E, Posthuma L (2000). Toxicokinetics of polycyclic aromatic hydrocarbons in Eisenia andrei (Oligochaeta) using spiked soil. Environ. Toxicol. Chem. 19: 953–961.
|
|
39)
|
Jager T, Baerselman R, Dijkman E, De Groot AC, Hogendoorn EA, DeJong A, Kruitbosch JAW, Peijnenburg W J G. M (2003a). Availability of polycyclic aromatic hydrocarbons to earthworms (Eisenia andrei, Oligochaeta) in field-polluted soils and soil-sediment mixtures. Environ. Toxicol. Chem. 22: 767–775.
|
|
40)
|
Jager T, Fleuren RLJ, Hoogendoorn E, de Korte G (2003b). Elucidating the routes of exposure for organic chemicals in the earthworm, Eisenia andrei (Oligochaeta). Environ. Sci. Technol. 37: 3399–3404.
|
|
41)
|
Janssen MPM, Bruins A, De Vries TH, Van Straalen NM (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305–312.
|
|
42)
|
Kasprzak K (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23: 217–232.
|
|
43)
|
Khalil AM (1990). Aufnahme und Metabolismus von 14C-Hexachlorbenzol und 14C-Pentachlornitrobenzol in Regenwürmern. Dissertation University München, 137 pp.
|
|
44)
|
Landrum PF (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23: 588–595.
|
|
45)
|
Marinussen MPJC, Van der Zee SEATM, De Haan FA (1997). Cu accumulation in Lumbricus rubellus under laboratory conditions compared with accumulation under field conditions. Ecotox. Environ. Safety 36: 17–26.
|
|
46)
|
Mount DR, Dawson TD, Burkhard LP (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegates. Environ. Toxicol. Chem. 18: 1244–1249.
|
|
47)
|
Nendza M (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations, In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems, Contributions to the assessment, Proceedings of an international workshop, Berlin 1990, VCH, Weinheim.
|
|
48)
|
Kapitola C.8 této přílohy - Toxicita pro žížaly.
|
|
49)
|
Kapitola C.13 této přílohy - Bioakumulace: průtoková zkouška na rybách.
|
|
50)
|
Kapitola C.21 této přílohy - Půdní mikroorganismy: zkouška na transformaci dusíku.
|
|
51)
|
OECD (2004a), Enchytraeid reproduction test, Test Guideline No. 220, Guidelines for the testing of chemicals, OECD, Paris.
|
|
52)
|
OECD (2004b), Earthworm reproduction test (Eisenia fetida/Eisenia Andrei), Test Guideline No. 222, Guidelines for the testing of chemicals, OECD, Paris.
|
|
53)
|
OECD (2008), Bioaccumulation in Sediment-dwelling Benthic Oligochates, Test Guideline No. 315, Guidelines for the testing of chemicals, OECD, Paris.
|
|
54)
|
Petersen H and Luxton M (1982). A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287-388.
|
|
55)
|
Phillips DJH (1993). Bioaccumulation. In: Handbook Ecotoxicology Vol. 1. Calow P. (ed.). Blackwell Scientific Publ., Oxford. 378–396.
|
|
56)
|
Pflugmacher J (1992). Struktur-Aktivitätsbestimmungen (QSAR) zwischen der Konzentration von Pflanzenschutzmitteln und dem Octanol-Wasser-Koeffzienten UWSF- Z. Umweltchem. Ökotox. 4: 77–81.
|
|
57)
|
Posthuma L, Weltje L, Anton-Sanchez FA (1996). Joint toxic effects of cadmium and pyrene on reproduction and growth of the earthworm Eisenia fetida. RIVM Report No. 607506001, Bilthoven.
|
|
58)
|
Randall RC, Lee II H, Ozretich RJ, Lake JL, Pruell RJ (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10: 1431–1436.
|
|
59)
|
Römbke J, Egele, P, Füll C (1998). Literaturstudie über Bioakkumulationstests mit Oligochaeten im terrestrischen Medium. UBA-Texte 28/98, 84 S.
|
|
60)
|
Römbke J and Moser Th (1999). Organisation and performance of an international ring-test for the validation of the Enchytraeid reproduction test. UBA-Texte 4/99: 373 pp.
|
|
61)
|
Römbke J, Riepert F, Achazi R (2000). Enchytraeen als Testorganismen, In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 105–129.
|
|
62)
|
Romijn CA.FM, Luttik R, Van De Meent D, Slooff W,Canton JH (1993). Presentation of a General Algorithm to Include Effect Assessment on Secondary Poisoning in the Derivation of Environmental Quality Criteria, Part 2: Terrestrial food chains. Ecotox. Envir. Safety 27: 107–127.
|
|
63)
|
Sample BE, Suter DW, Beauchamp JJ, Efroymson RA (1999). Literature-derived bioaccumulation models for earthworms: Development and validation. Environ. Toxicol. Chem. 18: 2110–2120.
|
|
64)
|
Schlosser H-J and Riepert F (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina), Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. NF 34: 413–433.
|
|
65)
|
Schmelz R and Collado R (1999). Enchytraeus luxuriosus sp. nov., a new terrestrial oligochaete species (Enchytraeide, Clitellata, Annelida). Carolinea 57: 93–100.
|
|
66)
|
Sims R W and Gerard BM (1985). Earthworms, In: Kermack, D. M. & Barnes, R. S. K. (Hrsg.): Synopses of the British Fauna (New Series) No. 31. 171 S. London: E. J. Brill/Dr. W. Backhuys.
|
|
67)
|
Sousa JP, Loureiro S, Pieper S, Frost M, Kratz W, Nogueira AJA, Soares AMVM (2000). Soil and plant diet exposure routes and toxicokinetics of lindane in a terrestrial isopod. Environ. Toxicol. Chem. 19: 2557–2563.
|
|
68)
|
Spacie A and Hamelink JL (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309–320.
|
|
69)
|
Stephenson GL, Kaushik A, Kaushik NK, Solomon KR, Steele T, Scroggins RP (1998). Use of an avoidance-response test to assess the toxicity of contaminated soils to earthworms. In: Advances in earthworm ecotoxicology. S. Sheppard, J. Bembridge, M. Holmstrup, L. Posthuma (eds.). Setac Press, Pensacola, 67–81.
|
|
70)
|
Sterenborg I, Vork NA, Verkade SK, Van Gestel CAM, Van Straalen NM (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167–1171.
|
|
71)
|
UBA (Umweltbundesamt, 1991). Bioakkumulation - Bewertungskonzept und Strategien im Gesetzesvollzug. UBA-Texte 42/91. Berlin.
|
|
72)
|
US EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition, EPA 600/R-99/064, US, Environmental Protection Agency, Duluth, MN, March 2000.
|
|
73)
|
Van Brummelen TC and Van Straalen NM (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277–285.
|
|
74)
|
Van Gestel CAM. (1992). The influence of soil characteristics on the toxicity of chemicals for earthworms; a review, In: Ecotoxicology of Earthworms (Ed. Becker, H, Edwards, PJ, Greig-Smith, PW & Heimbach, F). Intercept Press, Andover (GB).
|
|
75)
|
Van Gestel CA and Ma W-C (1990). An approach to quantitative structure-activity relationships (QSARs) in earthworm toxicity studies. Chemosphere 21: 1023–1033.
|
|
76)
|
Van Straalen NM, Donker MH, Vijver MG, van Gestel CAM (2005). Bioavailability of contaminants estimated from uptake rates into soil invertebrates. Environmental Pollution 136: 409–417.
|
|
77)
|
Venter JM and Reinecke AJ (1988). The life-cycle of the compost-worm Eisenia fetida (Oligochaeta). South African J. Zool. 23: 161–165.
|
|
78)
|
Vijver MG, Vink JPM, Jager T, Wolterbeek HT, van Straalen NM, van Gestel CAM (2005). Biphasic elimination and uptake kinetics of Zn and Cd in the earthworm Lumbricus rubellus exposed to contaminated floodplain soil. Soil Biol, Biochem. 37: 1843–1851.
|
|
79)
|
Widianarko B and Van Straalen NM (1996). Toxicokinetics-based survival analysis in bioassays using nonpersistent chemicals, Environ. Toxicol. Chem. 15: 402–406.
|
Dodatek 1
DEFINICE
|
|
Bioakumulace je nárůst koncentrace zkoušené chemické látky v organismu nebo na něm vzhledem ke koncentraci zkoušené chemické látky v okolním médiu. Bioakumulace je výsledkem biokoncentračních a bioobohacovacích procesů (viz níže).
|
|
|
Biokoncentrace je nárůst koncentrace zkoušené chemické látky v organismu nebo na něm příjmem zkoušené chemické látky výhradně z okolního média (tj. povrchem těla a ingescí půdy) vzhledem ke koncentraci zkoušené chemické látky v okolním médiu.
|
|
|
Bioobohacování je nárůst koncentrace zkoušené chemické látky v organismu nebo na něm hlavně příjmem kontaminované potravy nebo kořisti vzhledem ke koncentraci zkoušené chemické látky v této potravě nebo kořisti. Bioobohacování může vést k přestupu nebo akumulaci zkoušené látky v potravních řetězcích.
|
|
|
Vylučování zkoušené chemické látky je úbytek této chemické látky z tkáně zkoušeného organismu na základě aktivních nebo pasivních procesů, ke kterému dochází nezávisle na přítomnosti nebo nepřítomnosti zkoušené položky v okolním médiu.
|
|
|
Bioakumulační faktor (BAF) je koncentrace zkoušené látky ve zkoušeném organismu nebo na něm (Ca v g/kg suché hmotnosti červů) dělená koncentrací chemikálie v okolním médiu (Cs jako g/kg suché hmotnosti půdy), a to kdykoliv ve fázi příjmu při této bioakumulační zkoušce. Jednotkou BAF je kg půdy·na kg červů.
|
|
|
Bioakumulační faktor v ustáleném stavu (BAFSS) je BAF v ustáleném stavu a po dlouhou dobu se výrazně nemění; koncentrace zkoušené látky v okolním médiu (Cs jako g/kg suché hmotnosti půdy) je po tuto dobu konstantní.
|
|
|
Biokoncentrační faktory vypočtené přímo z poměru rychlostní konstanty příjmu z půdy a rychlostní konstanty vylučování (ks a ke, viz níže) se nazývají kinetický bioakumulační faktor (BAFK).
|
|
|
Akumulační faktor biota-půda (BSAF) je koncentrace zkoušené látky ve zkoušeném organismu nebo na něm normalizovaná na lipidy, dělená koncentrací zkoušené látky v půdě v ustáleném stavu normalizované na organický uhlík. Ca se pak vyjádří jako g/kg obsahu lipidů v organismu a Cs jako g/kg obsahu organických látek v půdě; jednotkami BSAF jsou kg OC na·kg lipidů.
|
|
|
Plató nebo ustálený stav je definován jako rovnováha mezi procesem příjmu a vylučování, k němuž dochází při fázi expozice současně. Ustáleného stavu je dosaženo tehdy, je-li při grafickém znázornění křivka časové závislosti BAF rovnoběžná s časovou osou a tři po sobě jdoucí analýzy BAF vzorků odebraných v intervalech alespoň dvou dnů se neliší více než o ±20 % a není-li mezi těmito třemi dobami odběru žádný statisticky významný rozdíl. V případě zkoušených látek, jejichž příjem probíhá pomalu, jsou vhodnější sedmidenní intervaly (49).
|
|
|
Rozdělovací koeficient organický uhlík/voda (Koc) je rovnovážný poměr mezi koncentrací chemické látky ve/na frakci organického uhlíku v půdě a koncentrace chemické látky ve vodě.
|
|
|
Rozdělovací koeficient n-oktanol/voda (Kow) je rovnovážný poměr mezi rozpustností chemické látky v n-oktanolu a ve vodě (někdy se označuje také jako Pow). Logaritmus hodnoty Kow (log Kow) se používá jako ukazatel potenciálu chemikálie bioakumulovat se ve vodních organismech.
|
|
|
Expozice nebo fáze příjmu je časový úsek, během něhož jsou zkoušené organismy vystaveny působení zkoušené chemické látky.
|
|
|
Rychlostní konstanta příjmu z půdy (ks) je číselná hodnota definující rychlost nárůstu koncentrace zkoušené položky ve zkoušených organismech nebo na nich v důsledku příjmu z půdní fáze. ks se vyjadřuje v g půdy na kg červů za den.
|
|
|
Vylučovací fáze je časový úsek po přemístění zkušebních organismů z kontaminovaného média do média, které zkoušenou látku neobsahuje, během něhož se studuje vylučování chemické látky ze zkušebních organismů (nebo její čistý úbytek v nich).
|
|
|
Rychlostní konstanta vylučování (ke) je číselná hodnota definující rychlost poklesu koncentrace zkoušené látky ve zkoušeném organismu nebo na něm po přemístění zkoušených organismů z média obsahujícího zkoušenou látku do média, které neobsahuje chemické látky; ke je vyjádřeno jako číselná hodnota za den.
|
|
|
Zkoušená chemická látka: jakákoliv látka nebo směs testovaná pomocí této zkušební metody.
|
Dodatek 2
Výpočet parametrů příjmu a vylučování
Hlavním koncovým bodem bioakumulační zkoušky je bioakumulační faktor BAF. Měřený BAF lze vypočítat tak, že se koncentrace ve zkušebním organismu Ca, vydělí koncentrací v půdě Cs v ustáleném stavu. Pokud není ustáleného stavu dosaženo během fáze příjmu, vypočte se BAFK z rychlostních konstant místo BAFSS. Je však třeba zaznamenat, zda je BAF založen na koncentracích v ustáleném stavu či nikoli.
Obvyklou metodou pro získání hodnoty kinetického bioakumulačního faktoru (BAFK), rychlostní konstanty příjmu (ks) a rychlostní konstanty vylučování (ke) jsou metody nelineárního odhadu parametrů s využitím počítače, např. na základě modelů popsaných v odstavci (68). Na základě souboru po sobě jdoucích údajů o koncentracích a modelových rovnic:
|
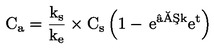
|
0 < t < tc
|
[rovnice 1]
|
nebo
|
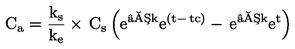
|
t > tc
|
[rovnice 2]
|
kde:
|
Ca
|
=
|
koncentrace chemické látky v červech [g/kg hmotnosti ve vlhkém stavu nebo suché hmotnosti],
|
|
ks
|
=
|
rychlostní konstanta příjmu v tkáni [g půdy na kg červů za den],
|
|
Cs
|
=
|
koncentrace chemické látky v půdě [g/kg hmotnosti ve vlhkém stavu nebo suché hmotnosti],
|
|
ke
|
=
|
rychlostní konstanta vylučování [1/d],
|
|
tc
|
=
|
čas konce fáze příjmu.
|
Tyto počítačové programy vypočtou hodnoty BAFK, ks a ke.
V případě, že se koncentrace neexponovaných červů například v den 0 významně liší od nuly (k tomu může dojít například v případě kovů), měla by být tato koncentrace v pozadí (Ca,0) zahrnuta do uvedených rovnic takto:
|
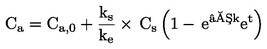
|
0 < t < tc
|
[rovnice 3]
|
a
|
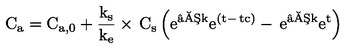
|
t > tc
|
[rovnice 4]
|
V případech, kdy dojde v průběhu času během fáze příjmu k významnému poklesu koncentrace zkoušené chemické látky v půdě lze použít následující modely, např. (67, 79):
|
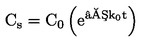
|
[rovnice 5]
|
kde:
|
Cs
|
=
|
koncentrace chemické látky v půdě [g/kg hmotnosti ve vlhkém stavu nebo suché hmotnosti],
|
|
k0
|
=
|
rychlostní konstanta rozkladu v půdě [1/d],
|
|
C0
|
=
|
počáteční koncentrace chemické látky v půdě [g/kg hmotnosti ve vlhkém stavu nebo suché hmotnosti].
|
|
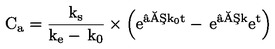
|
0 < t < tc
|
[rovnice 6]
|
|
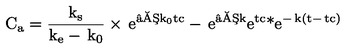
|
t > tc
|
[rovnice 7]
|
kde:
|
Ca
|
=
|
koncentrace chemické látky v červech [g na kg hmotnosti ve vlhkém stavu nebo suché hmotnosti],
|
|
ks
|
=
|
rychlostní konstanta příjmu v tkáni [g půdy na kg červů za den],
|
|
k0
|
=
|
rychlostní konstanta rozkladu v půdě [1/d],
|
|
ke
|
=
|
rychlostní konstanta vylučování [1/d],
|
|
tc
|
=
|
čas konce fáze příjmu.
|
Když je během fáze příjmu dosaženo ustáleného stavu (tj. t = ∞), rovnice 1
|
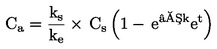
|
0 < t < tc
|
[rovnice 1]
|
může být zjednodušena na rovnici:
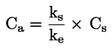
nebo
|
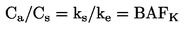
|
[rovnice 8]
|
Pak ks/ke x Cs je přiblížením ke koncentraci zkoušené látky ve tkáni červů v ustáleném stavu (Ca,ss).
Akumulační faktor biota-půda (BSAF) lze vypočítat následovně:
|
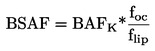
|
[rovnice 9]
|
kde foc je frakcí organického uhlíku v půdě a flip je frakcí lipidů v červech, obojí v optimálním případě stanoveno na vzorcích odebraných při zkoušce buď na základě hmotnosti po vysušení (foc) nebo živé váhy (flip).
Kinetiku vylučování lze modelovat pomocí dat z fáze vylučování za použití níže uvedené modelové rovnice a metody nelineárního odhadu parametrů s využitím počítače. Pokud data vynesená do grafu proti času indikují konstantní exponenciální pokles koncentrace zkoušené látky u zvířat, lze použít k popisu časového průběhu vylučování model s jedním kompartmentem (rovnice 9).
|
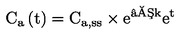
|
[rovnice 10]
|
Procesy vylučování se někdy jeví jako dvoufázové, neboť vykazují rychlý pokles Ca během raných fází, který se v pozdějších fázích vylučování změní na pomalejší úbytek zkoušených látek, např. (27) (68). Tyto dvě fáze mohou být interpretovány na základě předpokladu, že v organismu existují dva různé kompartmenty, z nichž dochází k úbytku zkoušené látky odlišnou rychlostí. V těchto případech je nutno studovat specifickou literaturu, např. (38, 39, 40, 78).
Pomocí výše uvedených modelových rovnic lze rovněž zároveň vypočítat kinetické parametry (ks a ke) uplatněním modelu kinetiky prvního řádu na všechna data z fáze příjmu a z fáze vylučování současně. Popis metody, která by mohla umožnit takovýto kombinovaný výpočet rychlostních konstant příjmu a vylučování, lze nalézt v odkazech (41, 73 a 70).
|
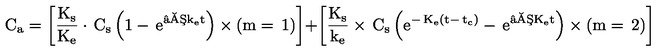
|
[rovnice 11]
|
|
Poznámka:
|
Pokud se parametry příjmu a vylučování odhadují současně z kombinovaných dat o příjmu a vylučování, je hodnota „m“ uvedená v rovnici 11 deskriptorem, který umožňuje počítačovému programu přiřadit dílčí členy rovnice datovým sadám příslušné fáze a provést správné vyhodnocení (m = 1 pro fázi příjmu, m = 2 pro fázi vylučování).
|
Tyto modelové rovnice je však nutno užívat obezřetně, zvláště v případě změn biologické dostupnosti zkoušené chemické látky nebo (bio) rozkladu, k nimž dojde během zkoušky (viz např. (79)).
Dodatek 3
PŘÍKLADY HARMONOGRAMŮ ZKOUŠEK BIOAKUMULACE V PŮDĚ
Zkouška na žížalách
|
a)
|
Fáze příjmu s 8 daty odběrů vzorků užitými pro výpočet kinetiky
|
Den
|
Činnost
|
|
– 6
|
kondicionování připravené půdy po dobu 48 hodin
|
|
– 4
|
vmíchání roztoku zkoušené chemické látky do půdní frakce, odpaření případného rozpouštědla, promísení půdních složek, rozdělení půdy do zkušebních nádob, ustavování rovnováhy při zkušebních podmínkách po dobu 4 dnů (3 týdny u půdy obohacené kovem)
|
|
– 3 až – 1
|
oddělení zkušebních organismů z kultury za účelem aklimatizace; příprava a zvlhčení půdních složek,
|
|
0
|
měření teploty a pH půdy, odstraňování vzorků půdy ze zkušebních nádob a kontrola rozpouštědel pro stanovení koncentrace zkoušené chemické látky, doplnění krmné dávky, zvážení a náhodné rozdělení červů do zkušebních nádob, zachování dostatečných dílčích vzorků červů pro stanovení analytických hodnot pozadí, hmotnosti ve vlhkém stavu a suché hmotnosti a obsahu lipidů, zvážení všech zkušebních nádob za účelem kontroly vlhkosti půdy, kontrola přívodu vzduchu, pokud je užit uzavřený zkušební systém
|
|
1
|
kontrola přívodu vzduchu, zaznamenání chování červů a teploty, odebrání vzorků půdy a červů za účelem stanovení koncentrace zkoušené položky
|
|
2
|
stejný jako 1. den
|
|
3
|
kontrola přívodu vzduchu, chování červů a teploty
|
|
4
|
stejný jako 1. den
|
|
5–6
|
stejný jako 3. den
|
|
7
|
stejný jako 1. den; doplnění krmné dávky, kontrola vlhkosti půdy převážením zkušebních nádob a doplnění odpařené vody
|
|
8–9
|
stejný jako 3. den
|
|
10
|
stejný jako 1. den
|
|
11–13
|
stejný jako 3. den
|
|
14
|
stejný jako 1. den; doplnění krmné dávky, kontrola vlhkosti půdy převážením zkušebních nádob a doplnění odpařené vody
|
|
15–16
|
stejný jako 3. den
|
|
17
|
stejný jako 1. den
|
|
18–20
|
stejný jako 3. den
|
|
21
|
stejný jako 1 den; měření teploty a pH půdy, kontrola vlhkosti půdy převážením zkušebních nádob, ukončení fáze příjmu, přenesení červů ze zbývajících exponovaných paralelních nádob do nádob obsahujících čistou půdu pro fázi eliminace (bez vyprázdnění střev), odběr vzorků půdy a červů z rozpouštědlové kontroly
|
|
|
adaptační činnosti (fáze ustavování rovnováhy) by měly být naplánovány s ohledem na vlastnosti zkoušené chemické látky
|
|
|
činnosti popsané pro 3. den by se měly provádět denně (alespoň v pracovní dny).
|
|
|
b)
|
Fáze vylučování
|
Den
|
Činnost
|
|
– 6
|
příprava a zvlhčení půdních složek, kondicionování připravené půdy po dobu 48 hodin
|
|
– 4
|
smísení půdních složek, rozdělení půdy do zkušebních nádob, inkubace při zkušebních podmínkách po dobu 4 dnů
|
|
0 (konec fáze příjmu)
|
měření teploty a pH půdy, vážení a náhodné rozdělení červů do zkušebních nádob, doplnění krmné dávky, přemístění červů ze zbývajících exponovaných paralelních vzorků do nádob obsahujících čistou půdu, odebrání vzorků půdy a červů po 4–6 hodinách za účelem stanovení koncentrace zkoušené chemické látky
|
|
1
|
kontrola přívodu vzduchu, zaznamenání chování červů a teploty, odebrání vzorků půdy a červů za účelem stanovení koncentrace zkoušené chemické látky
|
|
2
|
stejný jako 1. den
|
|
3
|
kontrola přívodu vzduchu, chování červů a teploty
|
|
4
|
stejný jako 1. den
|
|
5–6
|
stejný jako 3. den
|
|
7
|
stejný jako 1. den; doplnění krmné dávky, kontrola vlhkosti půdy převážením zkušebních nádob a doplnění odpařené vody
|
|
8–9
|
stejný jako 3. den
|
|
10
|
stejný jako 1. den
|
|
11–13
|
stejný jako 3. den
|
|
14
|
stejný jako 1. den; doplnění krmné dávky, kontrola vlhkosti půdy převážením zkušebních nádob a doplnění odpařené vody
|
|
15–16
|
stejný jako 3. den
|
|
17
|
stejný jako 1. den
|
|
18–20
|
stejný jako 3. den
|
|
21
|
stejný jako 1. den; měření teploty a pH půdy; kontrola vlhkosti půdy převážením zkušebních nádob; odběr vzorků půdy a červů z kontrol rozpouštědla
|
|
|
příprava půdy před zahájením fáze vylučování by měla být provedena stejným způsobem jako před fází příjmu.
|
|
|
činnosti popsané pro 3. den by se měly provádět denně (alespoň v pracovní dny)
|
|
Zkouška na roupicích
|
a)
|
Fáze příjmu s 8 daty odběrů vzorků užitými pro výpočet kinetiky
|
Den
|
Činnost
|
|
– 6
|
kondicionování připravené půdy po dobu 48 hodin
|
|
– 4
|
vmíchání roztoku zkoušené chemické látky do půdní frakce, odpaření případného rozpouštědla, promísení půdních složek, rozdělení půdy do zkušebních nádob, ustavování rovnováhy při zkušebních podmínkách po dobu 4 dnů (3 týdny u půdy obohacené kovem)
|
|
– 3 až – 1
|
oddělení zkušebních organismů z kultury za účelem aklimatizace; příprava a zvlhčení půdních složek
|
|
0
|
měření teploty a pH půdy, odstraňování vzorků půdy ze zkušebních nádob a kontrola rozpouštědel pro stanovení koncentrace zkoušené chemické látky, doplnění krmné dávky do půdy, zvážení a náhodné rozdělení červů do zkušebních nádob, zachování dostatečných dílčích vzorků červů pro stanovení analytických hodnot pozadí, hmotnosti ve vlhkém stavu a suché hmotnosti a obsahu lipidů, zvážení všech zkušebních nádob za účelem kontroly vlhkosti půdy, kontrola přívodu vzduchu, pokud je užit uzavřený zkušební systém
|
|
1
|
kontrola přívodu vzduchu, zaznamenání chování červů a teploty, odebrání vzorků půdy a červů za účelem stanovení koncentrace zkoušené položky
|
|
2
|
stejný jako 1. den
|
|
3
|
kontrola přívodu vzduchu, zaznamenání chování červů a teploty
|
|
4
|
stejný jako 1. den
|
|
5–6
|
stejný jako 3. den
|
|
7
|
stejný jako 1. den; doplnění krmné dávky do půdy, kontrola vlhkosti půdy převážením zkušebních nádob a doplnění odpařené vody
|
|
9
|
stejný jako 1. den
|
|
10
|
stejný jako 3. den
|
|
11
|
stejný jako 1. den
|
|
12–13
|
stejný jako 3. den
|
|
14
|
stejný jako 1. den; doplnění krmné dávky do půdy, měření teploty a pH půdy, kontrola vlhkosti půdy převážením zkušebních nádob, ukončení fáze příjmu, přenesení červů ze zbývajících exponovaných paralelních nádob do nádob obsahujících čistou půdu pro fázi vylučování (bez vyprázdnění střev), odběr vzorků půdy a červů z rozpouštědlové kontroly
|
|
|
adaptační činnosti (fáze ustavování rovnováhy) by měly být naplánovány s ohledem na vlastnosti zkoušené chemické látky
|
|
|
činnosti popsané pro 3. den by se měly provádět denně (alespoň v pracovní dny)
|
|
Dodatek 4
Umělá půda – doporučení pro přípravu a skladování
Vzhledem k tomu, že přírodní půda z určitého zdroje nemusí být k dispozici po celý rok a zkoušku mohou ovlivnit původní organismy i přítomnost mikroskopických znečišťujících látek, doporučuje se použít při této zkoušce umělý substrát, umělou půdu podle kapitoly C.8 této přílohy – Toxicita pro žížaly (48). V této půdě může přežít, růst a rozmnožovat se více zkušebních testovacích druhů a je zajištěna maximální standardizace i zkušební a kultivační podmínky srovnatelné vnitrolaboratorně i mezilaboratorně.
Složky půdy
|
Rašelina:
|
10 %
|
Sfagnová rašelina v souladu se směrnicí OECD č. 207 (48);
|
|
Křemenný písek:
|
70 %
|
Průmyslový křemenný písek (vysušený na vzduchu); velikost částic: více než 50 % částic by se měla pohybovat v rozpětí 50–200 μm, ale všechny částice by měly být ≤ 2 mm
|
|
Kaolinitický jíl
|
20 %
|
Obsah kaolinitu ≥ 30 %
|
|
Uhličitan vápenatý
|
≤ 1 %
|
CaCO3, práškový, chemicky čistý
|
Obsah organického uhlíku v umělé půdě lze podle potřeby snížit například snížením obsahu rašeliny na 4–5 % suché půdy a odpovídajícím zvýšením obsahu písku. Takovým snížením obsahu organického uhlíku se může snížit schopnost adsorpce zkoušené chemické látky (organický uhlík), do půdy a dostupnost zkoušené chemické látky pro červy se může zvýšit (74). Bylo prokázáno, že Enchytraeus albidus a Eisenia fetida mohou splnit kritéria validity pro reprodukci při testování v polních půdách s nižším obsahem organického uhlíku, např. 2,7 % (33), (61), a dle zkušenosti toho lze dosáhnout i v umělé půdě s 5 % obsahem rašeliny.
Příprava
Suché složky půdy se důkladně promísí (např. ve velké laboratorní míchačce). To by mělo být provedeno přibližně týden před zahájením zkoušky. Smíchané suché složky půdy by se měly navlhčit deionizovanou vodou minimálně 48 hodin před aplikací zkoušené chemické látky, aby se vyrovnala/stabilizovala kyselost. Hodnota pH se měří po smíchání půdy s roztokem 1M KCl v poměru 1:5. Pokud není hodnota pH v požadovaném rozsahu (6,0 ± 0,5), musí se do půdy přidat dostatečné množství CaCO3 nebo se musí připravit nová šarže půdy.
Maximální vodní kapacita (WHC) v umělé půdě se stanoví v souladu s normou ISO 11268-2 (35). Nejméně dva dny před započetím zkoušky se suchá umělá půda zvlhčí přídavkem dostatečného množství deionizované nebo rekonstituované vody, aby bylo dosaženo přibližně poloviny výsledného obsahu vody. Výsledný obsah vody by se měl rovnat 40 % až 60 % maximální vodní kapacity. Na začátku zkoušky se navlhčená půda rozdělí do tolika dávek, kolik je zkušebních koncentrací a kontrol při zkoušce, a obsah vlhkosti se upraví na 40–60 % WHCmax pomocí roztoku zkoušené chemické látky a/nebo přidáním deionizované nebo rekonstituované vody. Obsah vlhkosti se stanoví na začátku a na konci zkoušky (při 105 °C). Měl by optimálně vyhovovat potřebám jednotlivých druhů (obsah vlhkosti lze rovněž ověřit lehkým stlačením rukou a mezi prsty by se měly objevit pouze malé kapičky vody).
Uchovávání
Suché složky umělé půdy mohou být uchovávány při pokojové teplotě až do použití. Připravenou předvlhčenou půdu lze skladovat v chladu po dobu až tří dnů před vmícháním; je třeba dbát na minimalizaci odpařování vody. Půda obohacená zkoušenou látkou by měla být použita bezprostředně, pokud nejsou k dispozici informace o tom, že tuto určitou půdu lze skladovat bez vlivu na toxicitu a biologickou dostupnost zkoušené chemické látky. Vzorky obohacené půdy pak mohou být uchovány za podmínek doporučených pro konkrétní zkoušenou látku až do provedení analýzy.
Dodatek 5
Druhy terestrických máloštětinatců doporučené pro zkoušky bioakumulace z půdy
Žížaly
Doporučeným zkušebním druhem je Eisenia fetida (Savigny 1826), patřící do čeledi Lumbricidae. Od roku 1972 je rozdělen do dvou poddruhů (Eisenia fetida and Eisenia andrei (10)). Podle Jaenikeho (36) se jedná o samostatné oddělené druhy. Eisenia fetida je snadno rozpoznatelná podle jasně žlutých pruhů na článcích, zatímco Eisenia andrei má jednolitou tmavě červenou barvu. Oba druhy pravděpodobně pocházejí z černomořské oblasti a dnes jsou rozšířeny po celém světě, zejména v antropogenně modifikovaných přírodních stanovištích, jako jsou hromady kompostu. Oba tyto druhy lze použít pro ekotoxikologické zkoušky i pro zkoušky bioakumulace.
Eisenia fetida a Eisenia andrei jsou komerčně dostupné, např. jako rybí návnada Ve srovnání s jinými druhy z čeledi žížalovitých mají krátký životní cyklus, dosahují dospělosti za přibližně 2–3 měsíce (při pokojové teplotě). Jejich optimální teplota je přibližně 20 až 24 °C. Dávají přednost relativně vlhkým substrátům s téměř neutrálním pH a vysokým obsahem organických látek. Vzhledem k široce rozšířenému využívání těchto druhů ve standardizovaných ekotoxikologických zkouškách po dobu již asi 25 let je jejich kultivace dobře zavedena (48, 77).
Oba druhy lze chovat v celé řadě zvířecích exkrementů. Chovné médium, které doporučuje ISO (35) je 50:50 směs koňského nebo hovězího hnoje a rašeliny. Médium musí mít pH asi 6 až 7 (upraví se uhličitanem vápenatým) a nízkou iontovou vodivost (méně než 6 mS/cm nebo koncentraci solí nižší než 0,5 %), a nemělo by být příliš znečištěno amoniakem nebo zvířecí močí Lze použít rovněž komerční zahradní zeminu bez přísad nebo umělou půdu podle OECD (48), nebo jejich směs v poměru 50:50. Substrát musí být vlhký, ale ne příliš mokrý. Jako chovné nádoby jsou vhodné nádoby o objemu 10 až 50 litrů.
Pro získání červů standardního stáří a hmotnosti je nejlépe založit kulturu se zámotky. Dospělí červi se proto vloží do chovné nádoby obsahující čerstvý substrát umožňující vytvoření zámotků. Praktické zkušenosti ukázaly, že k dobrým hodnotám reprodukce vede hustota populace přibližně 100 dospělých červů na 1 kg substrátu (hmotnost ve vlhkém stavu). Po 28 dnech se dospělí červi vyjmou. Žížaly vylíhlé ze zámotků se použijí ke zkoušení poté, co dospějí (nejméně po dvou, ale po méně než dvanácti měsících).
Červy výše popsaných druhů lze považovat za zdravé, pokud se v substrátu pohybují, nepokoušejí se ze substrátu uniknout a nepřetržitě se rozmnožují. Velmi pomalý pohyb nebo žlutý zadní konec v případě Eisenia fetida) svědčí o vyčerpání substrátu. V takovém případě se doporučuje použít čerstvý substrát a/nebo snížit počet živočichů v nádobě.
Další vybrané odkazy
Gerard BM (1964). Synopsis of the British fauna. No. 6 Lumbricidae. Linnean Soc. London, 6: 1-58.
Graff O (1953). Die Regenwürmer Deutschlands. Schr. Forsch. Anst. Landwirtsch. 7: 1-81.
Römbke J, Egeler P, Füll C (1997). Literaturstudie über Bioakkumulationstests mit Oligochaeten im terrestrischen Medium. Bericht für das UBA F + E 206 03 909, 86 S.
Rundgren S (1977). Seasonality of emergence in lumbricids in southern Sweden. Oikos 28: 49-55.
Satchell JE (1955). Some aspects of earthworm ecology. Soil Zoology (Kevan): 180-201.
Sims RW and Gerard BM (1985). A synopsis of the earthworms. Linnean Soc. London 31: 1-171.
Tomlin AD (1984). The earthworm bait market in North America. In: Earthworm Ecology - from Darwin to vermiculture. Satchell, J.E. (ed.), Chapman & Hall, London. 331–338 pp.
Roupice
Doporučovaným zkušebním druhem je Enchytraeus albidus Henle 1837 (roupice bělavá). Enchytraeus albidus je jeden z největších druhů roupic (měří až 15 mm) z čeledi Enchytraeidae, řádu Oligochaeta, kmene Annelida a je celosvětově rozšířen, např. (8). Enchytraeus albidus lze nalézt v mořském, sladkovodním a suchozemském prostředí, zejména v rozkládajícím se organickém materiálu (chaluhách, kompostu) a pouze zřídkakdy na loukách (42). Tato široká ekologická tolerance a některé morfologické proměny naznačují, že tento druh může tvořit několik ras.
Enchytraeus albidus lze získat komerčně, protože se prodává jako krmivo pro ryby. Mělo by se ověřit, zda není kultura kontaminována jinými, obvykle menšími druhy (60). Pokud se znečištění objeví, omyjí se všechny roupice vodou v Petriho misce. Pomocí stereomikroskopu se následně vyberou velké dospělé exempláře Enchytraeus albidus jako počátek nové kultury. Všechny ostatní roupice se vyřadí. Tato roupice má krátký životní cyklus: dospělosti dosahuje mezi 33 dny (při 18 °C) až 74 dny (při 12 °C). Pro zkoušku mohou být použity pouze kultury, které byly bez problémů udržovány v laboratorních podmínkách minimálně 5 týdnů (jeden generační cyklus).
Jako zkušební organismy jsou vhodné i další druhy rodu Enchytraeus, zejména Enchytraeus luxuriosus. Tento druh je skutečným obyvatelem půdy, který byl nově popsán v (65). Pokud se použijí jiné druhy Enchytraeus, musí být jasně identifikovány a musí být logicky zdůvodněna volba druhu.
Enchytraeus crypticus (Westheide & Graefe 1992) je druh, který náleží ke stejné skupině jako Enchytraeus luxuriosus. Dosud nebylo s jistotou zjištěno, zda existuje ve volné přírodě, neboť byl popsán pouze v kulturách žížal a hromadách kompostu (Römbke 2003). Jeho původní ekologické požadavky proto nejsou známy. Nedávné laboratorní studie různých polních půd však potvrdily, že tento druh má širokou toleranci k vlastnostem půdy, jako je pH a struktura (Jänsch et al. 2005). Vzhledem k jednoduchosti jeho chovu a postupu zkoušení se v posledních letech tento druh velmi často používá při ekotoxikologických studiích, např. Kuperman et al. 2003). Avšak malá velikost (3–12 mm; v průměru 7 mm (Westheide & Müller 1996), je důvodem obtížnější manipulace s ním než s Enchytraeus albidus. Je-li použit tento druh namísto druhu Enchytraeus albidus, lze použít menší zkušební nádobu, není to však povinností. Navíc je potřeba vzít v úvahu, že tento druh se velmi rychle rozmnožuje – doba jeho reprodukce je kratší než 20 dnů při teplotě 20 ± 2 °C (Achazi et al. 1999) a při vyšších teplotách ještě kratší.
Enchytraeidae druhu Enchytraeus albidus (právě tak jako jiné druhy Enchytraeus sp.) je možno chovat ve velkých plastových boxech (např. 30×60×10 cm nebo 20×12×8 cm, který je vhodnější pro pěstování menších červů) naplněných směsí umělé půdy a komerčně dostupné přírodní neznečištěné zahradní půdy. Kompostovaný materiál by se neměl používat, protože by mohl obsahovat toxické chemické látky, jakými jsou těžké kovy. Před použitím by měla být z chovné půdy odstraněna veškerá fauna trojnásobným hlubokým zmrazením. Je možné použít také neznečištěnou umělou půdu, ale ve srovnání s míchanými substráty by reprodukce mohla být pomalejší. Substrát by měl mít pH 6,0 ± 0,5. Kultura se udržuje v inkubátoru ve tmě při teplotě 15 ± 2 °C. V každém případě by teplota neměla být vyšší než 23 °C. Umělá/přírodní půda by měla být vlhká, ale ne mokrá. Pokud se půda jemně stlačí rukou, měly by se objevit pouze malé kapičky vody. V každém případě by se mělo zabránit vzniku anaerobních podmínek (např. pokud se použije víčko, mělo by mít dostatečný počet otvorů, který umožní dostatečnou výměnu vzduchu). Chovný substrát by měl být jednou týdně provzdušňován opatrným promícháváním.
Roupice se krmí nejméně jednou týdně ad libitum ovesnými vločkami, které se umístí do dutiny na povrchy půdy a přikryjí se půdou. Pokud v nádobě zbude potrava od posledního krmení, mělo by se dodávané množství potravy odpovídajícím způsobem upravit. Pokud na zbylé potravě rostou plísně, měla by se nahradit novou dávkou ovesných vloček. Pro stimulaci reprodukce se do ovesných vloček může každé dva týdny přidat komerčně dostupný proteinový prášek s příměsí vitaminů. Po třech měsících se živočichové přemístí do čerstvě připravené kultury nebo chovného substrátu. Ovesné vločky, které se uchovávají v utěsněných nádobách, by se měly před použitím autoklávovat nebo zahřát, aby se zabránilo infikování roztoči (např. Glyzyphagus sp., Astigmata, Acarina) nebo dravými roztoči (např. Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina). Po dezinfekci se potrava rozdrtí, takže ji lze snadno rozsypat po povrchu půdy. Dalším možným zdrojem potravy jsou pekařské kvasnice nebo krmení pro ryby TetraMin®.
Obecně jsou podmínky pro kultivaci dostatečné, pokud se roupice nepokoušejí uniknout ze substrátu, pohybují se půdou rychle, povrch jejich těla je lesklý bez ulpělých částic půdy, mají víceméně bělavé zabarvení a jsou viditelné roupice různého stáří. Roupice lze považovat za zdravé, pokud se nepřetržitě rozmnožují.
Další vybrané odkazy
Achazi RK, Fröhlich E, Henneken M, Pilz C (1999). The effect of soil from former irrigation fields and of sewage sludge on dispersal activity and colonizing success of the annelid Enchytraeus crypticus (Enchytraeidae, Oligochaeta). Newsletter on Enchytraeidae 6: 117–126.
Jänsch S, Amorim MJB, Römbke J (2005). Identification of the ecological requirements of important terrestrial ecotoxicological test species. Environ. Reviews 13: 51–83.
Kuperman RG, Checkai RT, Simini M, Phillips CT, Kolakowski JE, Kurnas CW, Sunahara GI (2003). Survival and reproduction of Enchytraeus crypticus (Oligochaeta, Enchytraeidae) in a natural sandy loam soil amended with the nitro-heterocyclic explosives RDX and HMX. Pedobiologia 47: 651–656.
Römbke J (2003). Ecotoxicological laboratory tests with enchytraeids: A review. Pedobiologia 47: 607–616.
Westheide W and Graefe U (1992). Two new terrestrial Enchytraeus species (Oligochaeta, Annelida). J. Nat. Hist. 26: 479–488.
Westheide W and Müller MC (1996). Cinematographic documentation of enchytraeid morphology and reproductive biology. Hydrobiologia 334: 263–267.
“ |
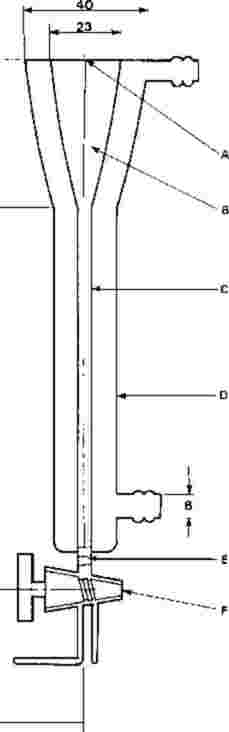
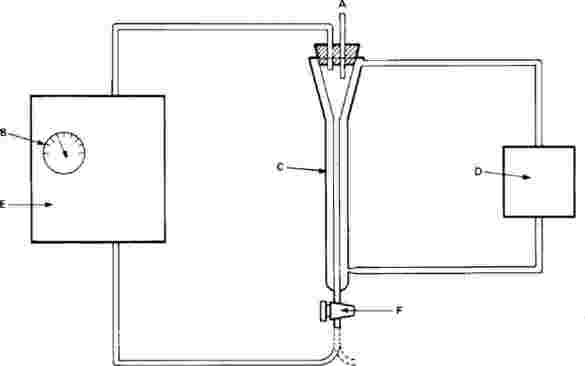
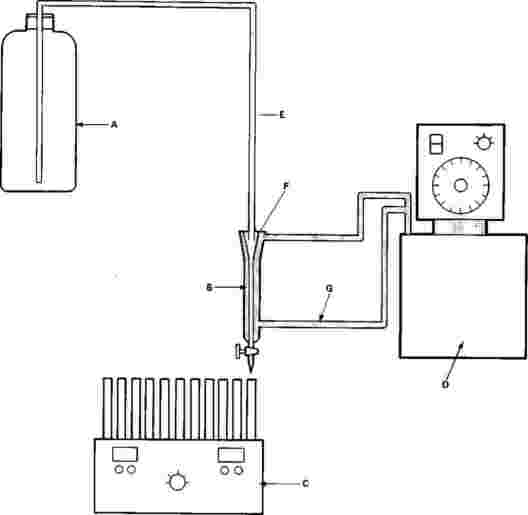
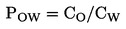
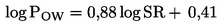
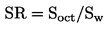 (v jednotkách molární koncentrace),
(v jednotkách molární koncentrace),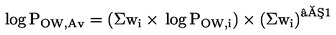
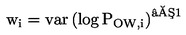
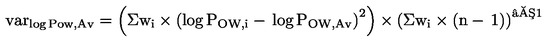
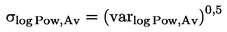
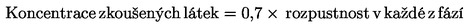 . V případě nižších koncentrací budou potřeba větší objemy.
. V případě nižších koncentrací budou potřeba větší objemy.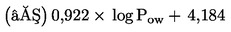
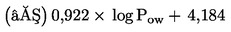
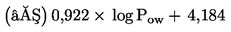
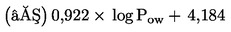
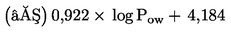
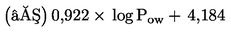
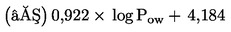
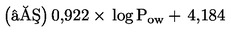
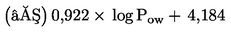
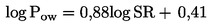
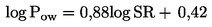
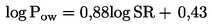
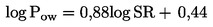
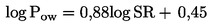
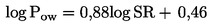
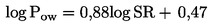
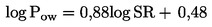
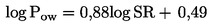
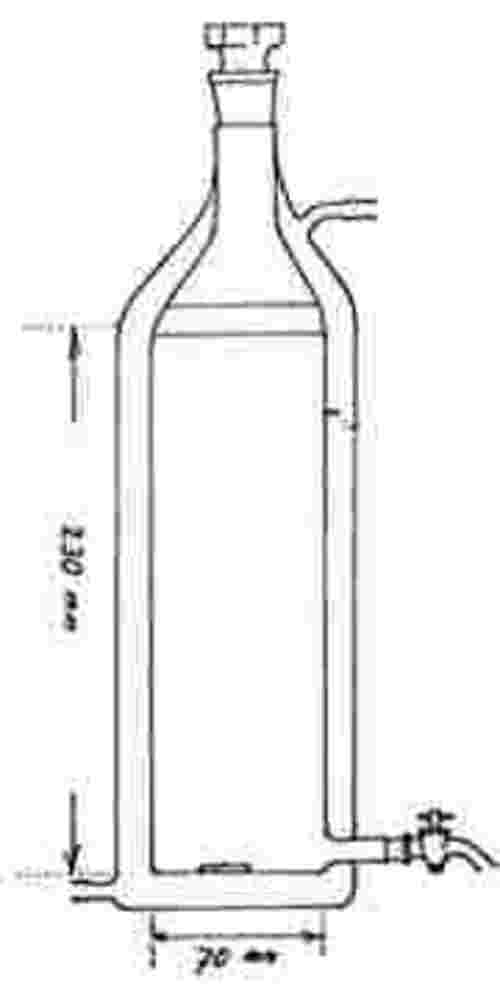
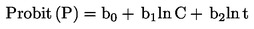
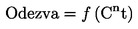
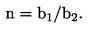
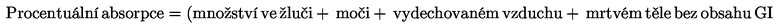
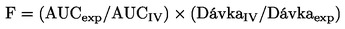
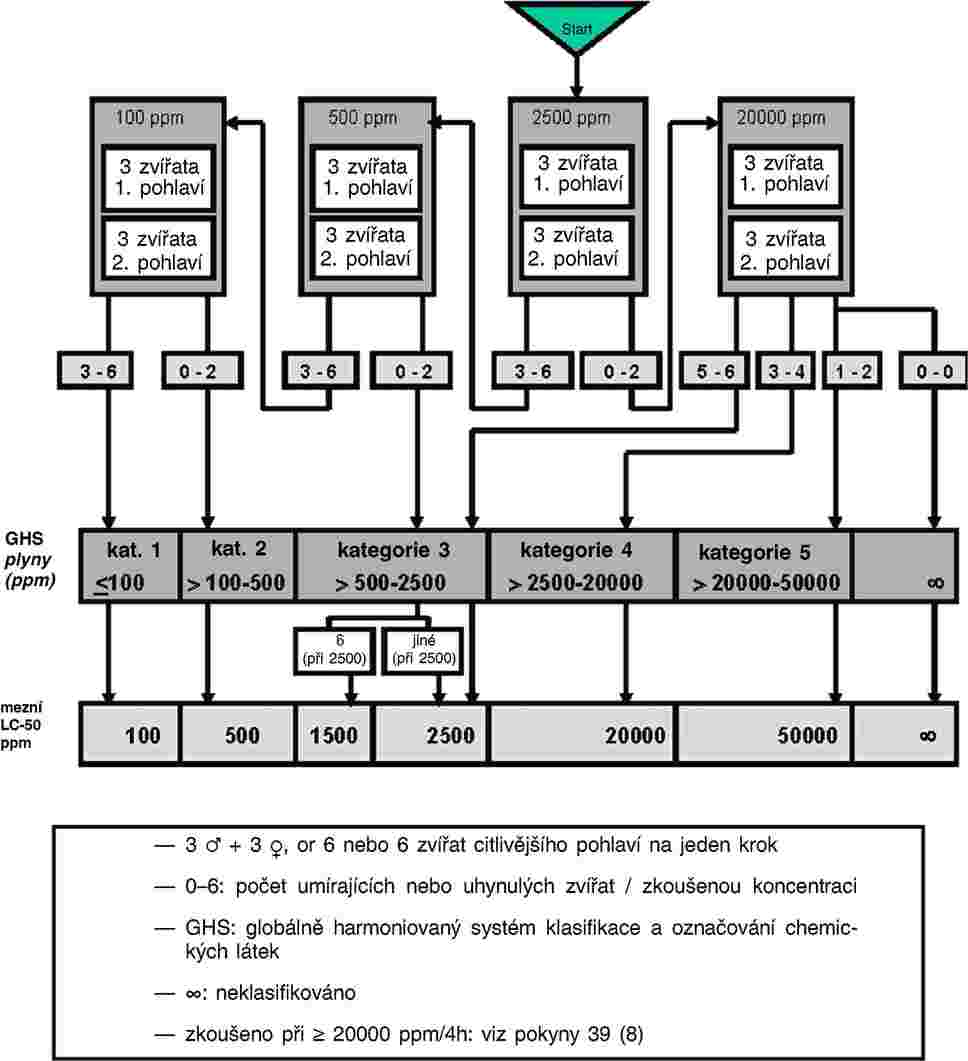
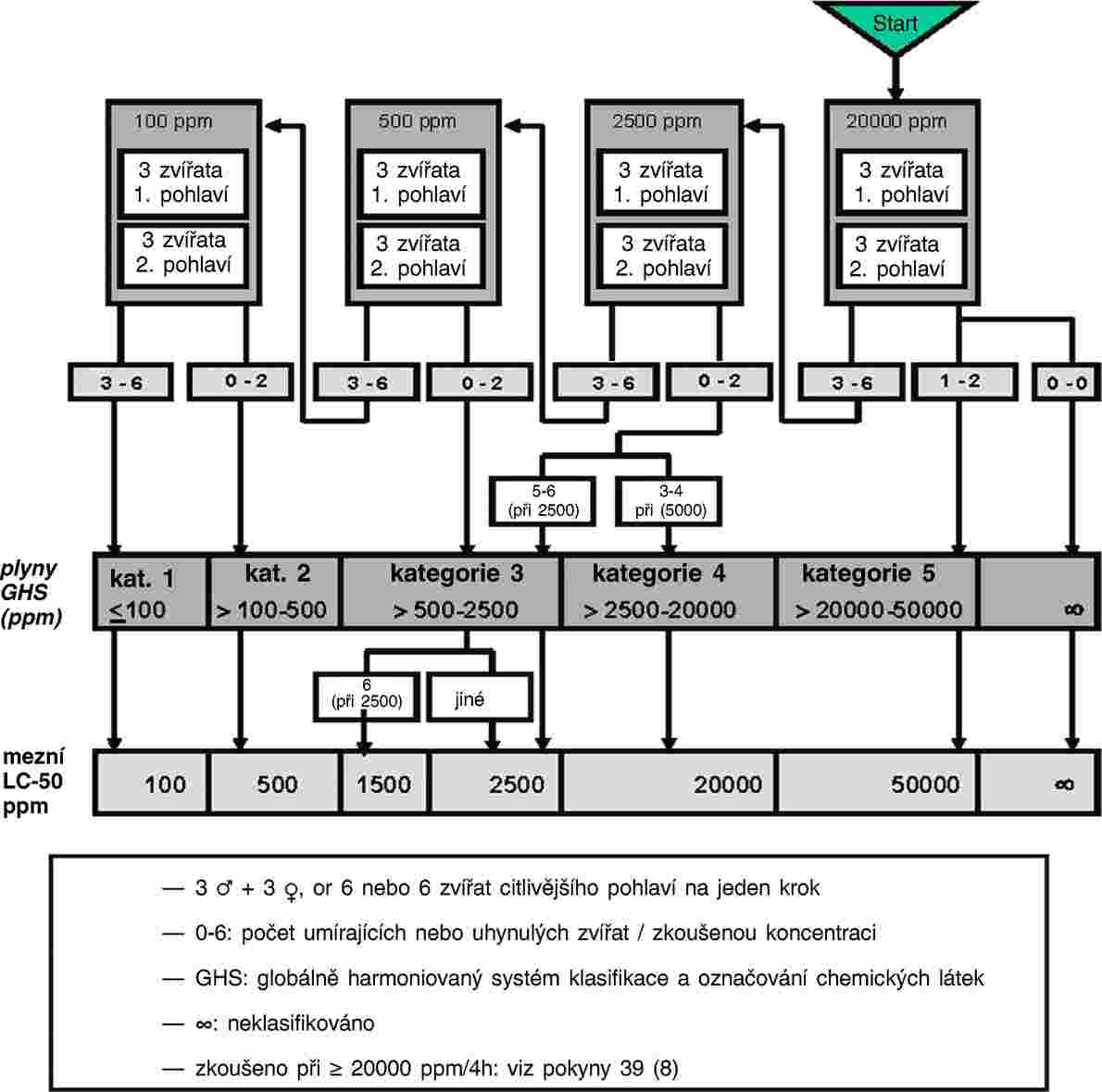
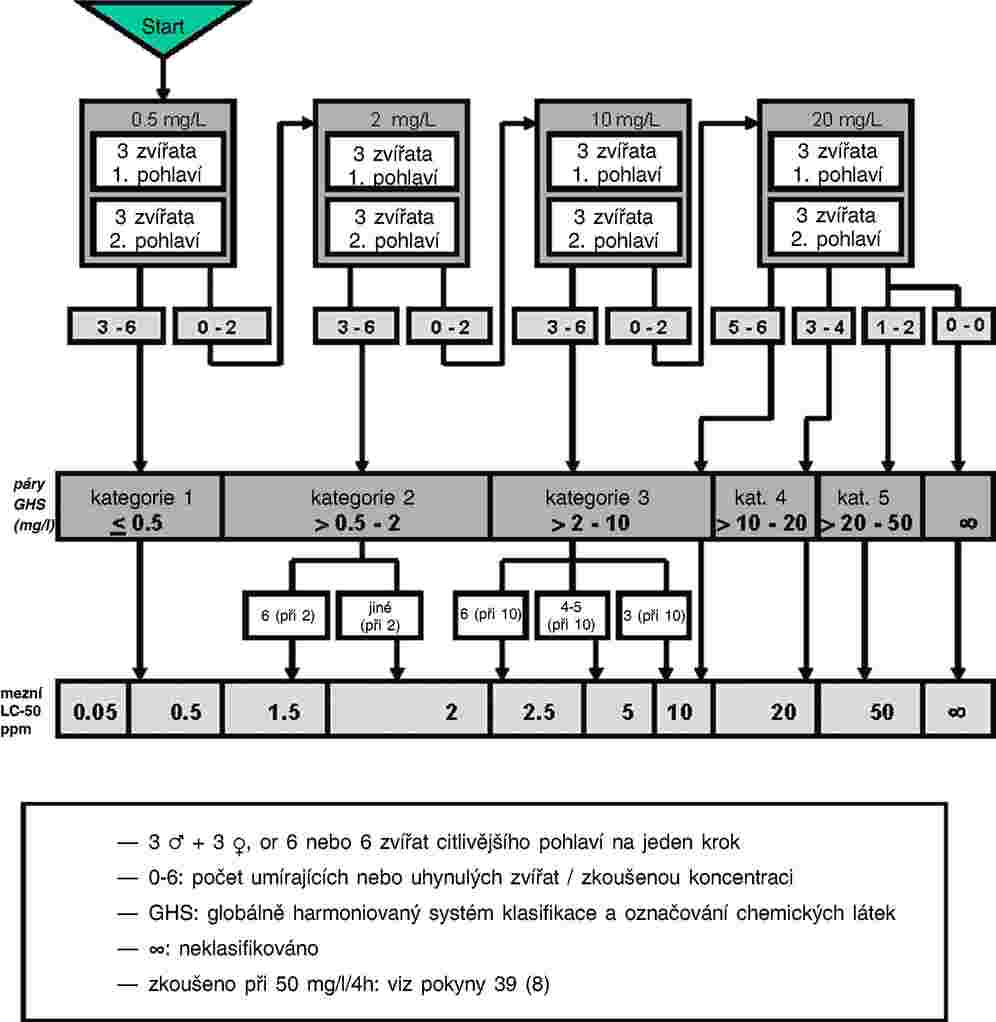
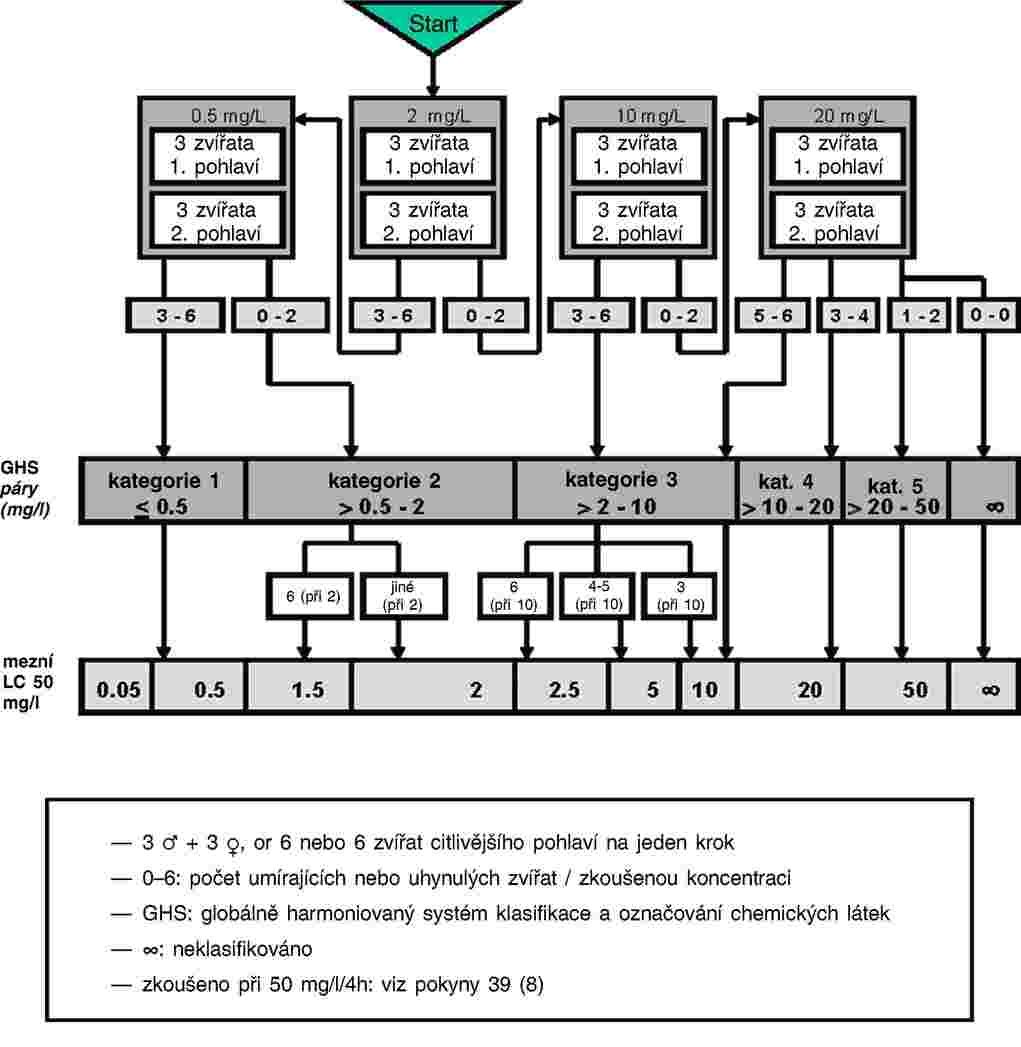
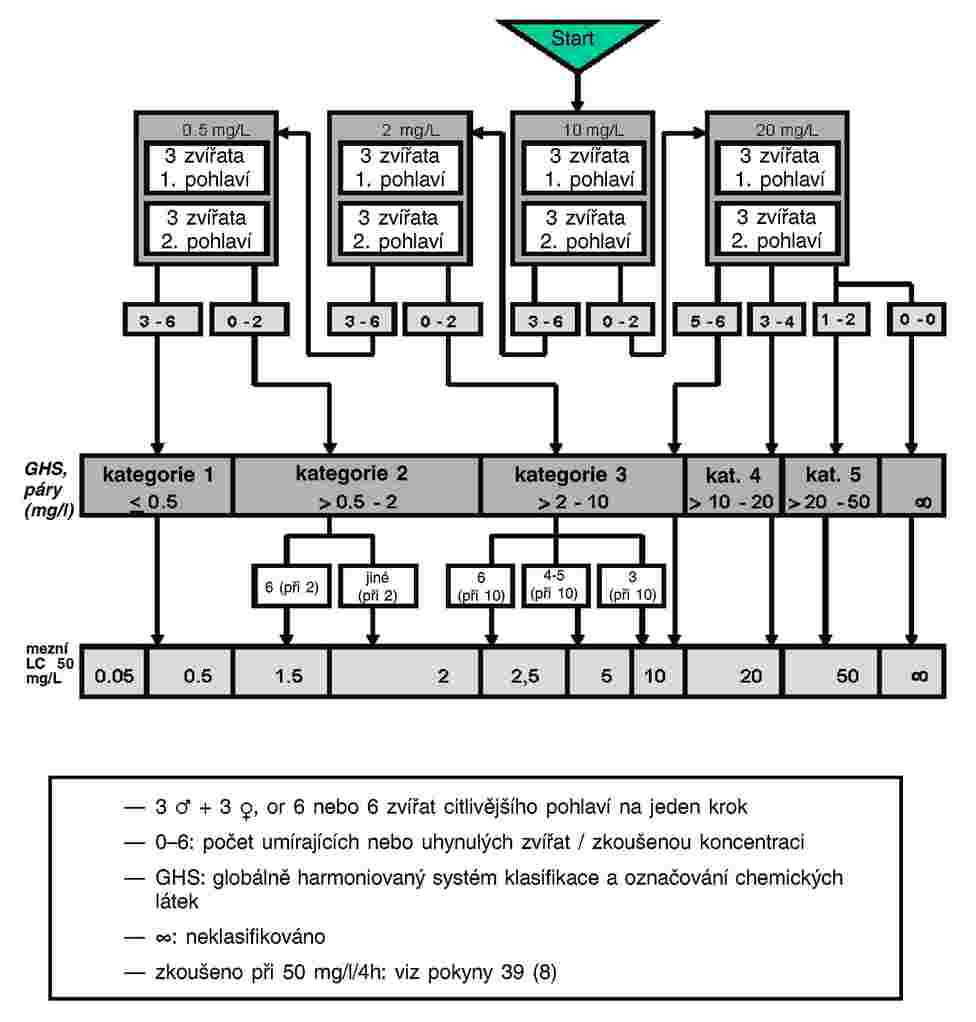
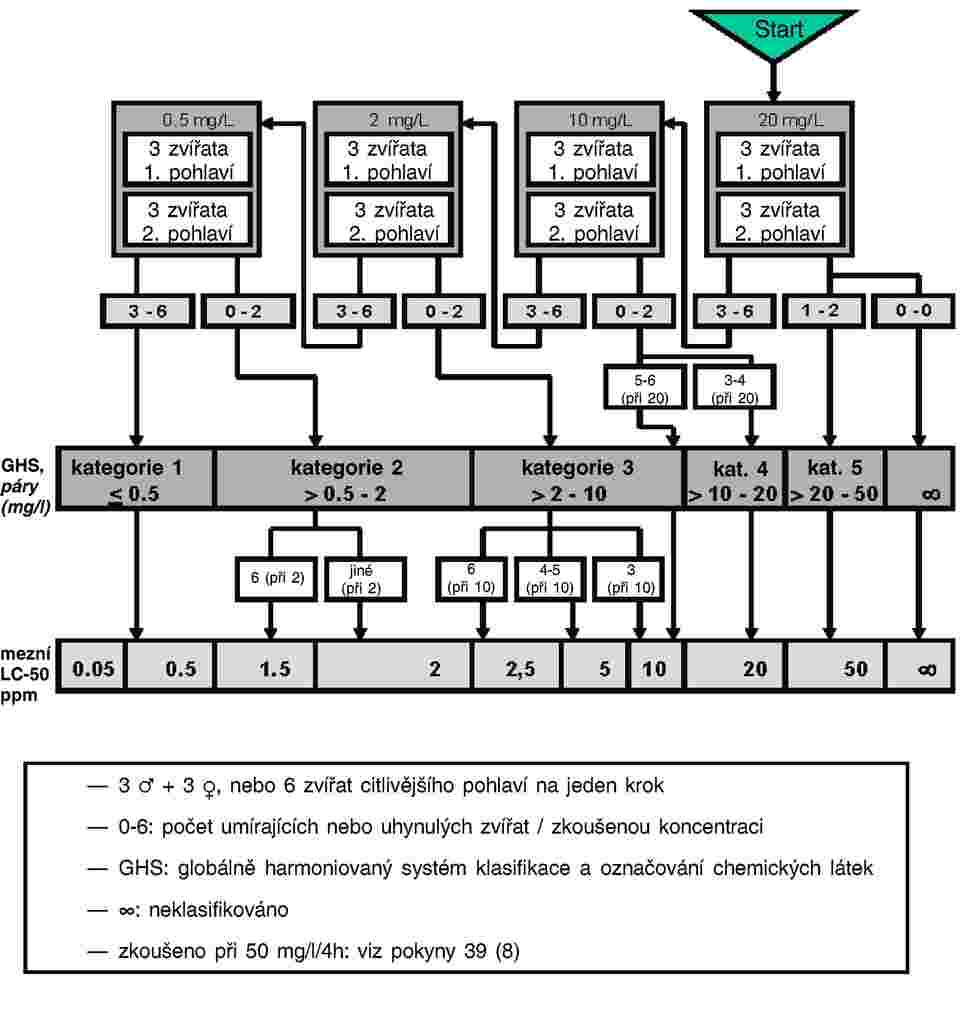
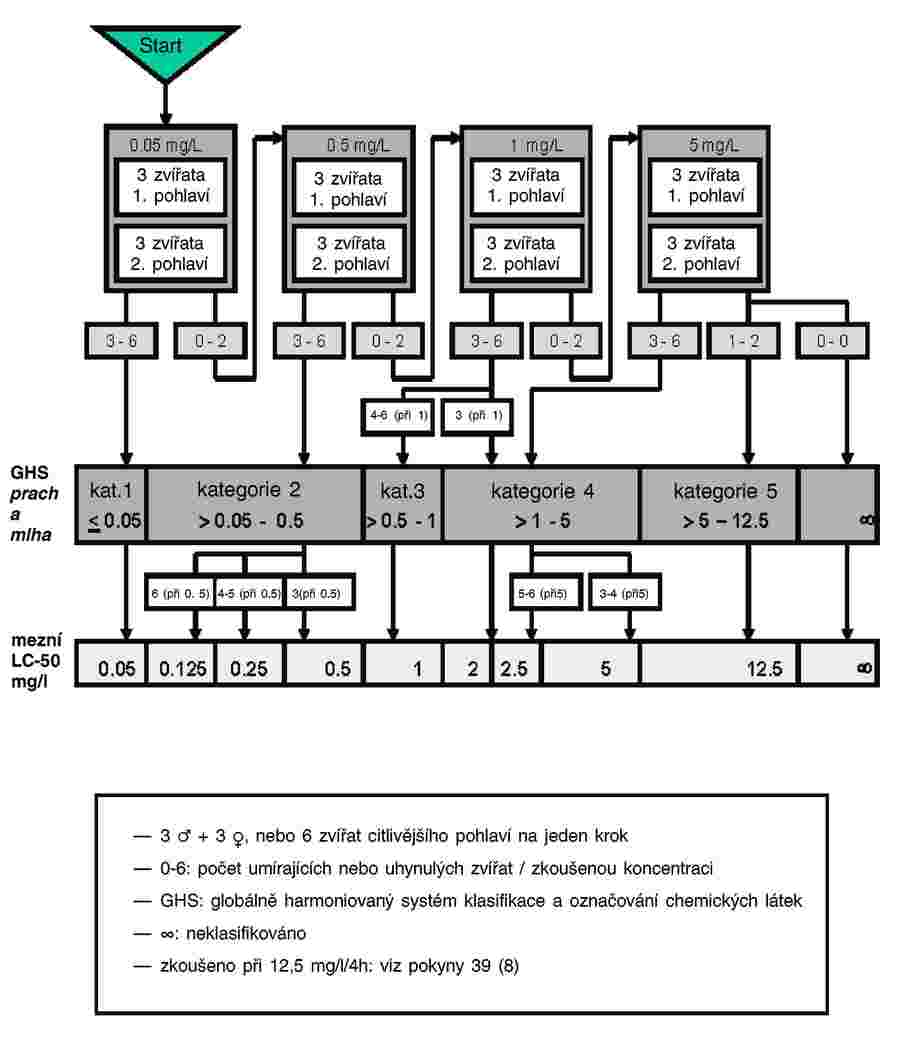
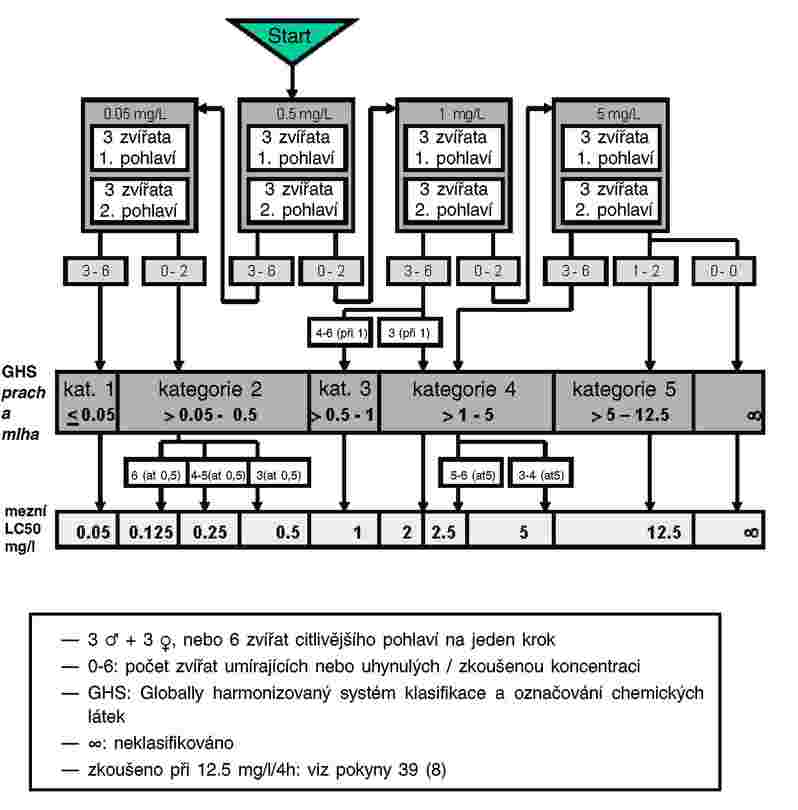
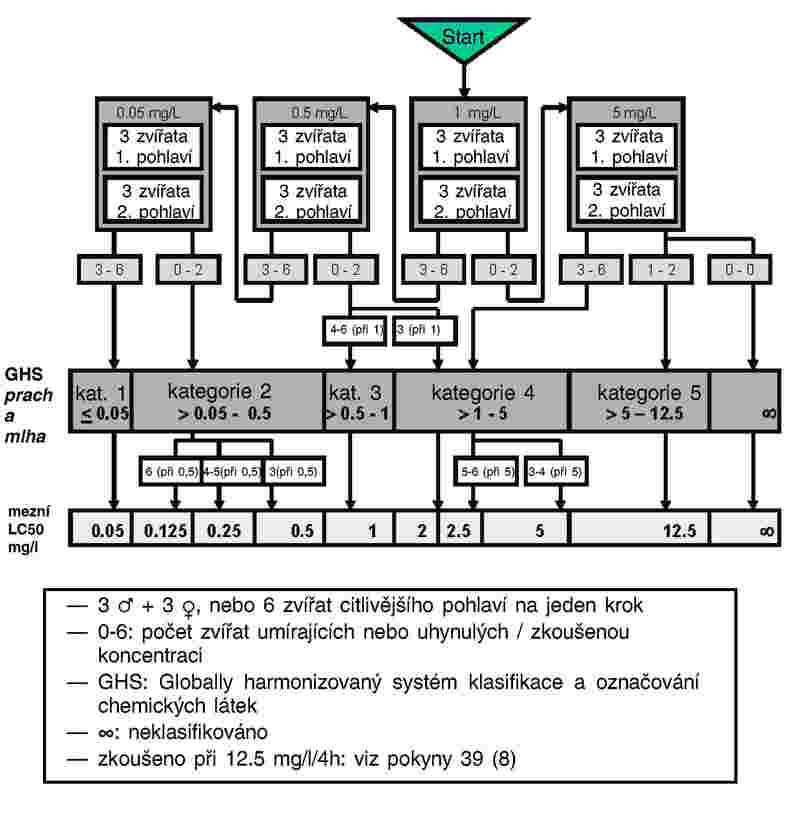
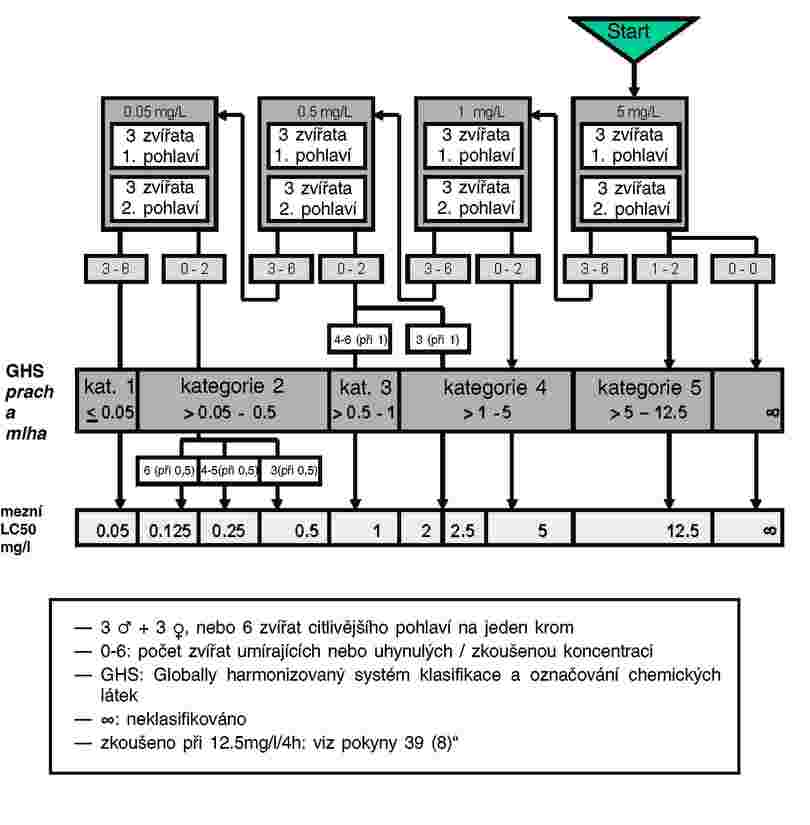
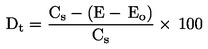
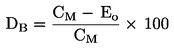
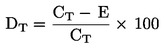
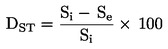
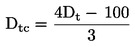
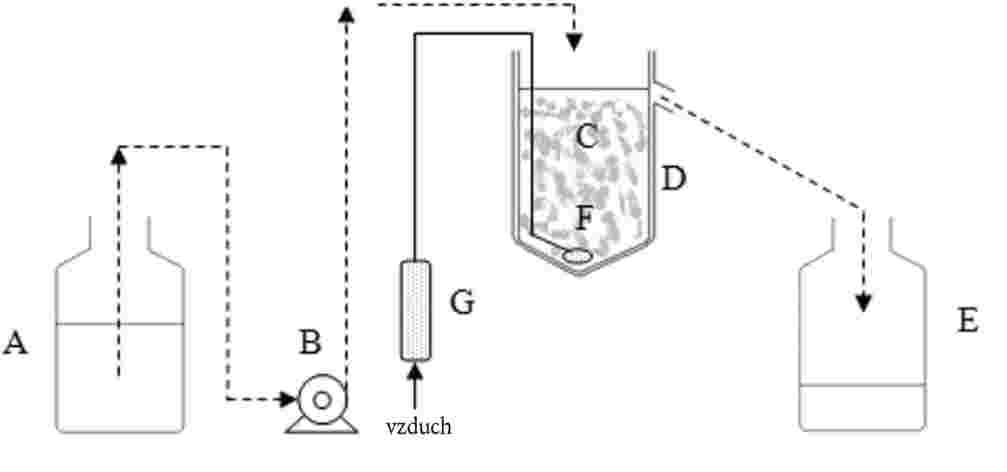
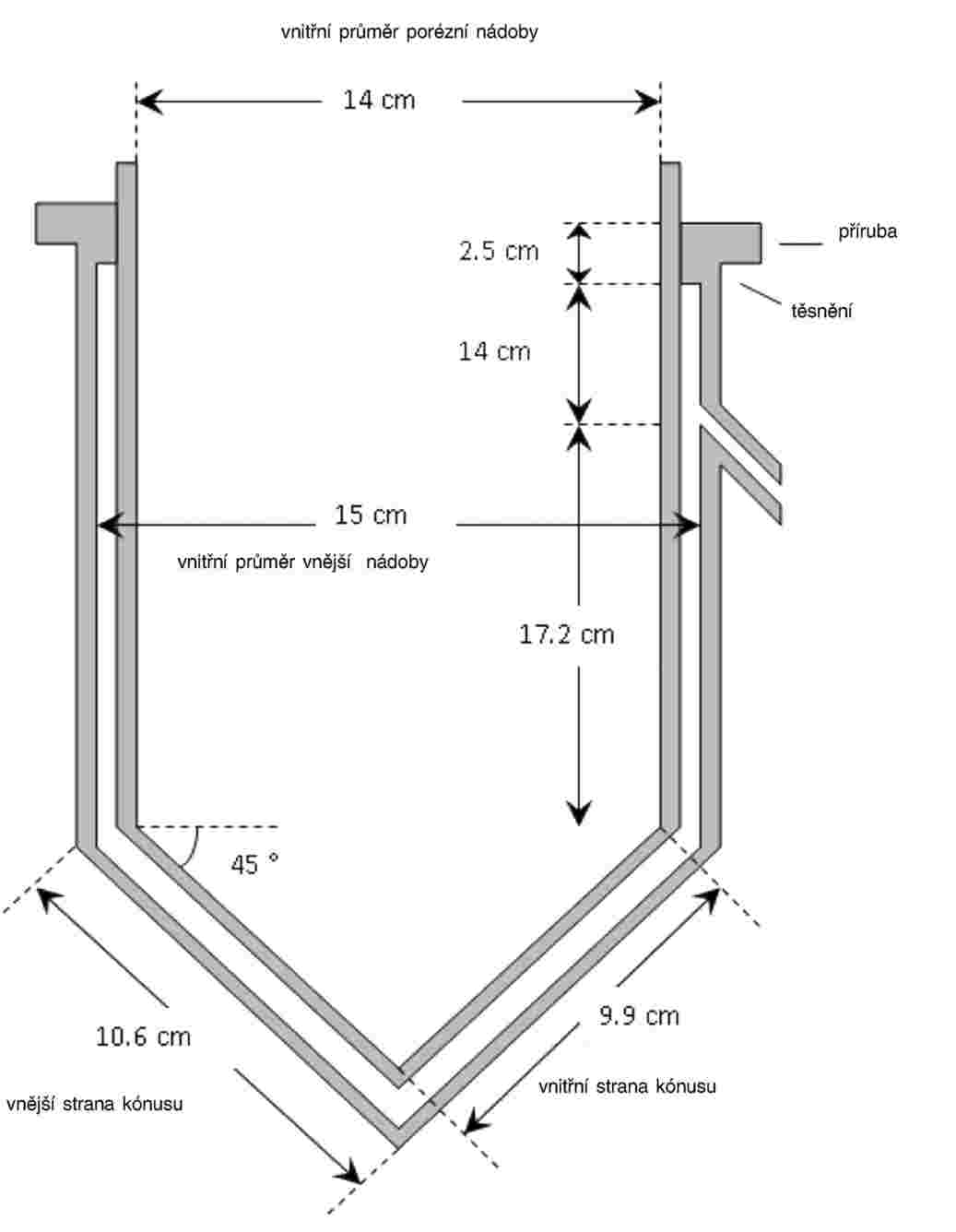
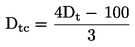
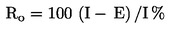
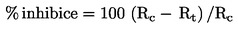
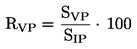
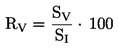
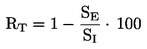
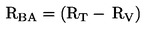
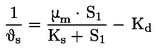
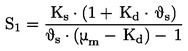
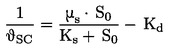
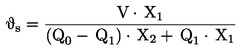
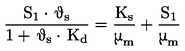
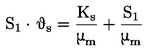
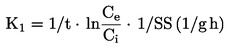
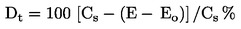
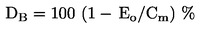
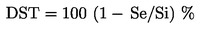
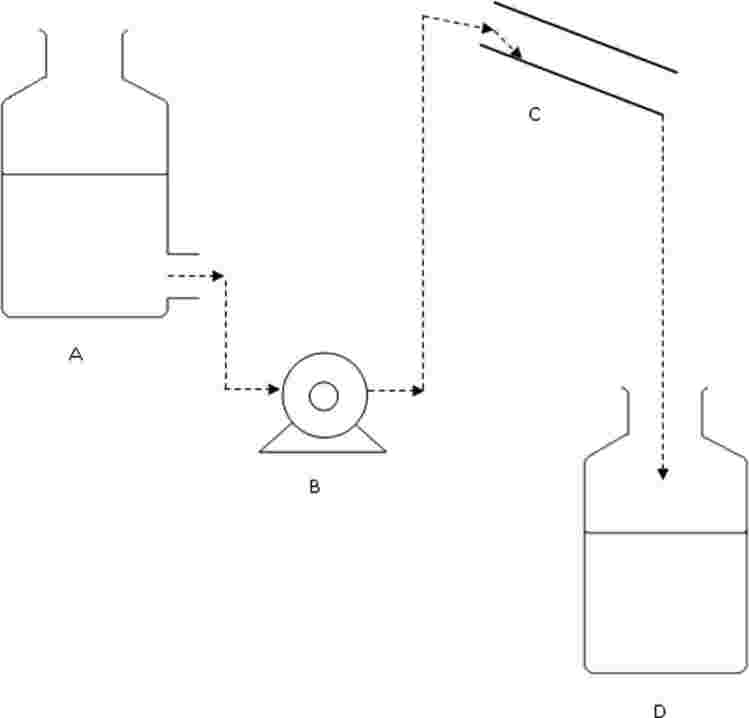
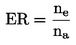
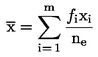
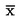
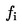
 ,
,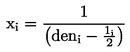

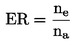
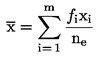
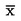
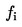
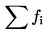 )
)